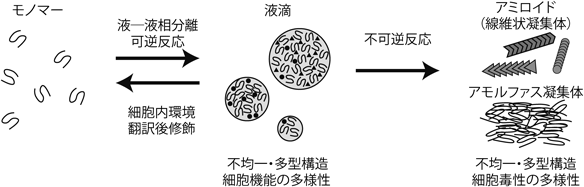
近年,タンパク質やRNAが示す液–液相分離現象が注目を集めている.それは,液–液相分離による液滴の形成がさまざまな生命現象を制御していることがわかってきたことに起因している.一方で,本来可逆的に生成する液滴が強く凝集してしまうことで不可逆的な凝集体,なかでも線維状の凝集体であるアミロイドの生成を導く可能性が示唆されている.このように,液–液相分離による液滴の形成は,可逆的な細胞機能制御というポジティブな面がある一方で,脳内に沈着し,界面活性剤やプロテアーゼに対して抵抗性のあるアミロイドの前駆体を導くというネガティブな面も指摘されている.本稿では,液–液相分離による液滴形成を示す疾患関連タンパク質として,翻訳終結に関わる酵母プリオンタンパク質Sup35, RNA結合タンパク質であり転写・翻訳制御,スプライシング制御などのRNAに関わる多様な機能を持つTDP-43,さらに,微小管結合タンパク質であり神経軸索の機能に重要なタウに関する最近の知見を紹介する.
Sup35タンパク質は,現在約10個ほど知られている酵母プリオンタンパク質の一つであり,ヒトのプリオンタンパク質のようにその凝集体が鋳型となって次々に単量体(モノマー)を鋳型と同じ凝集構造に転換させ,それを娘細胞へと伝播する.これまで,酵母プリオンタンパク質は,多くの神経変性疾患関連タンパク質の凝集体が示す“プリオン様伝播”の分子メカニズムの解明に多大な貢献をしてきている.Sup35は685アミノ酸からなり,アミノ末端領域にグルタミン・アスパラギンに富む配列があるため凝集性が高く,線維状のタンパク質凝集体であるアミロイドを容易に形成する.著者らは2010年に,Sup35のプリオンドメインを含み,アミロイド線維の生成に十分なSup35の一部であるSup35NMを用いて研究を進めていたところ,興味深いことに,精製したSup35NMは試験管内で4°Cなどの低温下でオリゴマーを生成することを見いだした1).さらに驚くべきことに,そのオリゴマーの形成は可逆的であり,温度を上げて37°Cにすると完全にモノマーに解離し,また4°Cに戻すとオリゴマーを再形成したことから,そのオリゴマー–モノマー間の平衡が温度で容易に変化することを見いだした1).また,その平衡は温度だけでなく,緩衝液中の塩濃度などの構成成分によっても変化した.重要なことに,そのオリゴマーは,アミロイド形成のオンパスウェイにあり,アミロイド形成を促進する構造体であった.この構造体はアミロイドの前駆体またはアミロイド伸長時にSup35モノマーがアミロイド末端に付加する際の足場であることが示唆された.
一方で,Albertiらは,2018年に,酵母の細胞の中でもSup35が可逆的に液滴を形成し,それが酵母を培養する培地のグルコースやpHの変化によって制御を受けることを示した2).とりわけ,中性よりもやや酸性のpH 6で,また,より低い塩濃度やストレス下でSup35が酵母内で顕著な液滴形成を示し,それがゲル様の構造をとること,その生成はストレスの解除によって消失することから,可逆的な生成であることを示した(図1).さらに興味深いことに,Sup35NMよりカルボキシ末端に存在し,翻訳終結の機能を果たすSup35-Cだけを用いて同様の実験を行うと,不可逆的なSup35-Cの凝集が起こってしまいストレスからの回復も遅くなることがわかり,液滴の生成は凝集性の高いプリオンドメインを含むSup35NMドメインによって媒介されていることを示した.つまりSup35はプリオンドメインがあることで,液–液相分離した際に可逆性のある液滴を形成し,ストレスからの回復過程を早めていることを示している.このように,Sup35の液滴形成は,ストレス下でも,そのあとのストレス解除に備えた準備をしているとも考えられ,可逆的に液滴を形成することでタンパク質機能を潜在的に維持しつつも,ストレスが解除されたあとにすばやく液滴を解放してSup35モノマーが翻訳終結機能を首尾よく果たすことができるようにしている,という意味合いを持つ.このような液滴形成を利用した細胞のストレス対処戦略は,著者らがMod5という別の酵母プリオンタンパク質や[KIL-d]というタンパク質性の遺伝因子でも見つけている3, 4).これはタンパク質の可逆的な凝集形成を利用した細胞のストレスへの対処法として,長い年月を要するゲノムの変異を必要とせずに迅速に機能スイッチングを行うことができる優れた戦略であると思われる.
3. ALSやFTLDに関わるTDP-43の液–液相分離
414アミノ酸からなりRNA結合タンパク質であるTDP-43は,筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS)や前頭側頭葉変性症(frontotemporal lobar degeneration:FTLD)の原因タンパク質として広く知られており,その神経細胞内での凝集形成はこれら疾患の発症に深く関わっている.TDP-43はアミロイド様の凝集体を形成する一方で,これまでの研究から可逆的に液–液相分離し,液滴を生成することも見いだされている.特に低複雑性ドメイン(low complex domain:LCD)と呼ばれる約270から414番目までのアミノ酸領域は,グリシン,セリン,アスパラギンなど,その領域を構成するアミノ酸の種類が少なく,高い凝集性を示す.TDP-43-LCDは試験管内で容易に液滴形成をすることが知られており,それはアミロイド形成の前駆体になる可能性も示唆されている.興味深いことに,最近,テキサス大学サウスウエスタン校の加藤らによって,TDP-43-LCDの液滴形成に,メチオニン残基の酸化によるスルホキシド化が深く関与していることが指摘された(図1)5).実際に,TDP-43-LCDのアミノ酸配列をみると全プロテオームでみられるよりも高い比率でメチオニン残基を含むという特徴に気づく.興味深いことに,TDP-43-LCDの液滴形成はメチオニンを酸化する過酸化水素の処理によって消失し,その後,メチオニンスルホキシドの還元酵素であるMsrA/MsrBで処理することで液滴が再形成される.
このような液滴の形成は全長のTDP-43ではみられないため,生体内でそのような生成機序は起こりうるのだろうかという疑問が生じる.ALSやFTLDの患者では,TDP-43はアミノ末端部分が細胞内で切断されており,TDP-43-LCDに比較的近いアミノ酸配列を含むドメインが神経細胞内で生じていることが知られている.したがって,生体内においてもTDP-43-LCDによって可逆的に液滴が生成している可能性や,その液滴の生成が不可逆性になり,シード(たね)となってアミロイドが形成していく可能性が十分に考えられる.一方で,このような液滴形成が細胞内および個体の中でどれだけ起こっているのか,またその生理的,病的な影響は不明である.さらに,TDP-43-LCDによるこのような液滴形成がTDP-43の本来持つスプライシング活性やその他の細胞機能にどのような変化をもたらすのか,その液滴形成の生理的意義は十分には理解されていないため,今後の研究が待たれる.
スルホキシド化以外にも液–液相分離に関わる翻訳後修飾としてよく知られているものにユビキチン化やリン酸化がある.なかでも本稿では神経変性疾患にも深く関わるリン酸化について以下に述べる.タンパク質はリン酸化によってSDS-PAGEの移動度が変わるほどに極性が大きく変わることが知られているため,リン酸化が液–液相分離や液滴生成に関わる可能性が示唆され,その影響が精力的に調べられている(図1).その一例として,微小管結合タンパク質であるタウタンパク質はアルツハイマー病やピック病,大脳皮質基底核変性症などの認知症に広く関わり,液–液相分離を示すことが知られている.試験管内で,タウタンパク質は,細胞内を模倣した分子クラウディング試薬(ポリエチレングリコールなど)の存在下で,光退色後蛍光回復法(FRAP)で速い蛍光の回復を示すという典型的な液滴を形成する6).また,液滴の形成が塩濃度に依存すること,タウには芳香族アミノ酸があまりないこと,疎水的相互作用を壊すヘキサンジオールへの感受性が弱いことから,タウの液–液相分離には静電的な相互作用が寄与すると示唆されている7).特に,分子クラウディングの存在が液滴の形成を顕著に促進する一方で,液–液相分離の制御因子の一つであるATPの濃度には依存しないことが指摘されている.タウのアミロイド構造は,微小管結合ドメイン領域が中心になって形成されていることが最近のクライオ電子顕微鏡による解析から明らかにされているが,意外なことに,タウの液滴形成は全長(1~441)もしくは,アミノ末端から微小管結合ドメインに至るまでのアミノ末端領域で生じ,凝集性が高いと思われる微小管結合ドメインだけでは液滴は形成しない.このことは,液滴の形成がタウタンパク質の自己会合を促進させ,将来,微小管結合ドメインが中心となってアミロイド形成を誘導するための足場としての構造体になっている可能性を想起させる.
一方で,タウの液–液相分離は家族性の前頭側頭型認知症パーキンソニズム(FTDP-17)に関与するP301L変異で顕著に促進される6, 8).つまり,P301L変異によって,タウがより低濃度で液滴を形成できるようになり,また液滴のサイズも大きくなる.さらに,野生型タウの液滴に比べて,FRAPでの蛍光分子の蛍光回復が遅くなったことから,液滴の不可逆性が増大していることが示唆された.この液滴は,オリゴマーを認識するTOC1抗体や,S202およびT205のリン酸化を認識するAT8抗体で認識される6).また,タウのリン酸化が液滴形成に必要であるという報告9)もある一方で,リン酸化のない全長タウでも液–液相分離が生じるという報告6)もあり,タウの液–液相分離にリン酸化が必須かどうかはまだ十分に理解されていない.
タウの液滴を比較的長い間放置しておくと,βシート構造に富んだアミロイドに結合する蛍光分子チオフラビンSの蛍光で染まるため,アミロイド線維の生成が示唆される8).一方で,電子顕微鏡の観察から,線維状ではないアモルファス(無秩序)な凝集体が生成するという報告もあり6),タウの液–液相分離がアミロイド線維の前駆体というよりはTOC1抗体で認識されるアモルファスなオリゴマーの生成を導くことも示唆されている.さらに,タウの液滴は,アミノ末端の露出した病的なPAD(phosphatase-activating domain)構造を認識するTNT2抗体でも認識される.これらの結果は,液–液相分離による液滴形成が長時間続くことで,別のタイプの凝集体構造へと不可逆的に移行し,PAD構造が露出する病的なコンホメーションを持つ液滴が生じる可能性が指摘されている.このように,特異的な抗体を用いて液滴の構造タイピングを行うことは,液–液相分離現象の理解を深めると考えられる.
以上のことから,タウの液滴が,ある一定時間の経過後にアミロイド線維かアモルファスな凝集体を導くかの違いは,液滴が最初に生成する際の緩衝液の成分や液滴生成後の放置時間など,さまざまな条件の違いによって生じると考えられる.また,亜鉛やヘパリン,RNAなどの陰イオン性の補因子がタウの液–液相分離に影響を及ぼすことからも7),タウの液滴には構造および物性の異なる多型が生じうると考えられる.さらには,そのような液滴の構造多型が最終的に生じる凝集体構造の多型を導く可能性も容易に示唆される(図1).このように,液–液相分離でどのような液滴を生じるか,それが不可逆的な変化によって線維状のアミロイドかアモルファスな凝集体を導くかは,その緩衝液や細胞内環境の違いおよび翻訳後修飾などを含むタンパク質自身によっても大きく異なる.可逆的な液–液相分離現象は動的な平衡下にあり,タンパク質構造ひいては細胞機能に多様性を生み出す源になっている可能性が示唆される.試験管内での現象にとどまらず,生理的条件下の細胞や個体の中で同様な液–液相分離がみられるか,また,その液滴形成の生理的意義の解明は今後の課題であろう.
次の章では,液–液相分離が不可逆的に移行した結果として生じる病理的影響の具体例として,Sup35のアミロイド線維,特にアミロイドの伝播効率に深く関わるアミロイドの脱凝集過程について最新の知見もふまえて概説する.
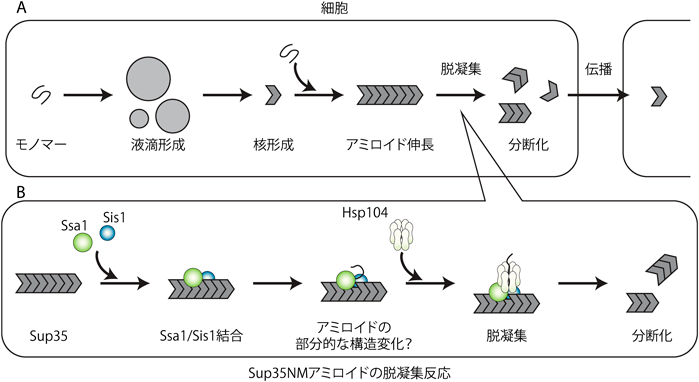
タンパク質が線維状に凝集したアミロイドは,アルツハイマー病やパーキンソン病などの神経変性疾患の原因とされている.モノマーから核(シード,たねとも呼ばれる)が最初に生成し,それを鋳型としてモノマーが順次結合し,構造変化して線維状に伸長する.成長したアミロイドは自発的もしくは細胞内因子によって分断され,それが再びシードとなることでアミロイドは伸長していく(図2).これまでの研究では,アミロイドの核形成や伸長の過程に着目したものが中心であり,アミロイドの分断や脱凝集に注目した研究は,それを調べるための実験系がなかったため,かなり限られている.しかし,アミロイドの分断・脱凝集は新たなシードを作り出すという点で非常に重要な反応である上,細胞内でも脱凝集は起こっており,それはタンパク質の恒常性(プロテオスタシス)の維持に影響を与えることが示唆されている.また,小さく断片化されたアミロイドはエンドサイトーシスやエキソサイトーシスの経路に入って細胞内外に輸送されやすいと考えられるため,アミロイドの脱凝集は,アミロイドの細胞間伝播の効率にも非常に深く関わっていると考えられる.
これまでに酵母の系では実際に,アミロイドの分断速度は成長速度に比べて,細胞表現型に与える影響が大きいことが実験および数理モデルの解析から明らかになっている9).さらに,脱凝集活性の低下はアミロイドの細胞間伝播の効率を減少させることがわかっている10).これらのことから,アミロイドの分断・脱凝集は,アミロイドが脳内で広がり伝播する多くの神経変性疾患の発症や進行に深く関わると示唆される.
しかし,アミロイドの脱凝集過程を解析するための実験系や手法が十分に確立されていないため,その詳細なメカニズムには不明な点が多い.そのためには,細胞内で生じる脱凝集過程を試験管内で再現するためのin vitro再構成実験系の開発と,アミロイドの脱凝集過程を計測する手法の開発が不可欠である.本稿では,酵母のアミロイドの脱凝集を再現するin vitro再構成実験系と,クライオ電子顕微鏡単粒子解析によるアミロイドの構造解析に関する最新の脱凝集研究を紹介する.これらの研究が発展することで,液–液相分離との類似性や差異の理解も深まり,神経変性疾患の予防や治療に対する新しい知見が得られると期待される.
酵母ではアミロイドの生成・脱凝集を制御する因子が示唆されているため,アミロイドの脱凝集メカニズムの解明に関して,酵母プリオンタンパク質Sup35に着目した研究が進んでいる.酵母におけるアミロイドの脱凝集制御メカニズムが明らかになれば,それを応用して哺乳類のアミロイド性タンパク質を制御し,神経変性疾患の抑制に貢献できる可能性も示唆される.2004年,ShorterらはSup35NMによって形成されるアミロイドがAAA+ATPaseファミリーに属するHsp104のみによって脱凝集されることを見いだした11).しかし,Hsp104以外の細胞内因子も脱凝集に関与するという複数のin vivoおよびin vitroの結果と一致していない.さらに,酵母を用いた研究では,Hsp70, Hsp40の機能喪失によりSup35アミロイドの伝播が抑制されることが見いだされているため,Hsp70, Hsp40もSup35アミロイドの脱凝集に関わると考えられている.我々は,酵母のアミロイドの脱凝集を3種類のシャペロン[Hsp104, Ssa1(Hsp70), Sis1(Hsp40)]によってin vitroで再現する“再構成系”を開発してきた.
中川らは,そのin vitro再構成系を用いて全反射照明蛍光顕微鏡(total internal reflection fluorescence microscope:TIRF)の手法からSup35アミロイドの脱凝集過程を詳細に調べた12).蛍光ラベルしたアミロイドおよび各シャペロンの挙動を同時にリアルタイムで観察することで,次のような反応機構を提案した.まず,アミロイドにSsa1およびSis1が同時に結合する.次にSsa1/Sis1が結合した部位にHsp104が結合し,脱凝集反応が開始する.Hsp104はそのアミロイドの同一部位へ結合・解離を繰り返しながらアミロイドを脱凝集する(図2).興味深いことに,Ssa1/Sis1のアミロイドへの結合からHsp104の結合まで一定の待機時間(~73秒)が観測された.この待機時間にSup35アミロイドの構造変化が起こり,Hsp104によって認識されやすい構造へと変化するのではないかと考えられる.
一方で,アミロイドの構造には,線維の中心を形成する静的な部位(コア領域)と特定の構造を持たずに線維の外側で揺らいでいる領域が存在するが,コア領域の構造の違いにより,脱凝集のようすが異なることも明らかになった.コア構造の異なる2種類のアミロイド(Sc4およびSc37)の脱凝集反応をTIRFによって比較したところ,アミノ末端から2~42番目までとコア構造の領域が小さいSc4アミロイドでは線維が細かく切り刻まれて「分断」されるのに対して,2~72番目までとコア領域が大きなSc37ではSsa1/Sis1シャペロンがアミロイドの全体を覆うように結合し,Hsp104によってSc37アミロイドの蛍光が全体的に徐々に均一に消えていく「溶解」を示した.さらに,各シャペロンとの親和性にも違いが現れ,Sc37アミロイドの方がより親和性が高いことが示された.このような違いはSup35NMが形成するSc4およびSc37アミロイドの構造の差異に由来すると考えられる.
TIRFではリアルタイム観察が可能である一方で構造情報の分解能が低いため,分子レベルでのタンパク質の構造変化を計測することができない.今後,より分解能が高い構造解析手法を用いて脱凝集過程を観測することができれば,脱凝集のより詳細なメカニズムを明らかにできると期待される.
哺乳類などの後生生物ではHsp104のホモログが失われており,酵母のようなHsp104, Hsp70, Hsp40によるアミロイドの強力な脱凝集システムがない.そのため,Hsp104によらない別の脱凝集機構が存在すると考えられている.2015年にGaoらは,Hsp110, Hsc70, Hsp40の3種のシャペロンがパーキンソン病の原因とされるα-シヌクレイン線維の脱凝集に関わっていることを見いだした13).さらに最近Wentinkらは,核磁気共鳴法とアミロイドに特異的に結合する蛍光色素(チオフラビンT)を用いた脱凝集活性測定により,その脱凝集メカニズムを明らかにした14).Hsp40ファミリーに属するDNAJB1がアミロイドに結合するとHsc70がアミロイド上に誘導される.これによりHsc70がDNAJB1付近に蓄積されて密度が増し,entropic pullingと呼ばれる分子どうしの反発効果によってアミロイドが分断される.このとき,ヌクレオチド交換因子であるHsp110は分子サイズが大きく,密になったHsc70には接近できないため,Hsc70が高密度でアミロイドに結合している部位から離れた位置に結合してしまったHsc70に対してより効率的にATP交換反応を行う.それによってHsc70がさらに局所密度を高め,entropic pullingが効率よく起こるように誘導することで,Hsp110はアミロイドの分断効率の増大に寄与していると説明した.一方で,Schneiderらは,マイクロ流体を用いて分子拡散から分子のサイズが変化していくようすを観測し,α-シヌクレイン線維の脱凝集過程を調べた15).脱凝集反応中,アミロイドが時間とともに徐々に小さくなっていく際に,オリゴマーは観察されずにα-シヌクレインのモノマーが検出されるだけであったため,脱凝集反応はα-シヌクレイン線維の端から徐々に進行していき,分断は起きないとし,DNAJB1によって誘導されたHsc70がα-シヌクレインのモノマーを端から次々と脱凝集させるメカニズムを提案した.
いずれにせよ,これらの反応は直接的に脱凝集する分子の振る舞いを観測したわけではなく,その詳細なメカニズムは不明なままである.また,Hsc70を中心とするentropic pullingによる脱凝集反応と,Hsp104を中心とするpower strokeによるモノマー引き抜きによる脱凝集反応との違いの詳細は不明である.今後の研究の発展による,これら二つの脱凝集反応の解明に期待したい.
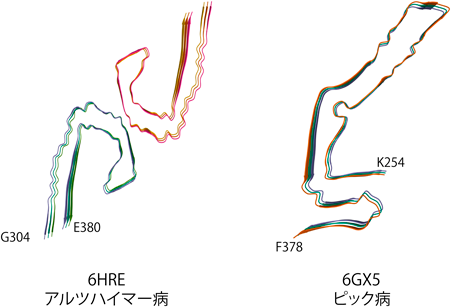
タンパク質の機能を説明するためには,その構造を明らかにすることが重要である.タンパク質は個々のアミノ酸残基どうしの化学結合によって形づくられている.特にアミロイドは,同じタンパク質であっても多様な構造(構造多型)(図3)を示し,それは,それぞれの細胞毒性や伝播効率,関連する疾患表現型に大きな差異が現れる分子基盤になっている.つまり,アミロイドの性質と病的影響を理解するためには,その構造情報を得ることが重要である.さまざまな形のアミロイドの脱凝集過程を観測・比較することで,どのような構造がアミロイドの分断および脱凝集のトリガーになるかを明らかにできると期待される.
タンパク質の構造を観測する手法として,X線結晶構造解析があげられる.この手法では,タンパク質を結晶化した試料にX線を照射することで得られるX線の回折像からタンパク質の三次元構造を再構成する.X線結晶構造解析は,これまでに多くのタンパク質の構造を明らかにしており,タンパク質の構造解析において不可欠な技術となっている.しかしアミロイドは,結晶化が困難なためX線結晶構造解析によって構造を観測することは難しい.そのため,X線結晶構造解析によるアミロイドの構造研究は一部の短いペプチド鎖で形成される部分構造での構造解析にとどまっていた.
しかし近年,クライオ電子顕微鏡(クライオ電顕)技術の発達により,アミロイドの構造研究は飛躍的に進歩した.クライオ電子顕微鏡単粒子解析は急速凍結したタンパク質溶液を透過型電子顕微鏡で観測し,その投影像からタンパク質の三次元構造を再構成する手法である.試料中に存在するさまざまな角度のタンパク質粒子の二次元投影像を大量に収集し,方向ごとに分類・平均化して三次元構造を再構成する.この手法ではタンパク質の結晶化が不要であるため生理条件下でタンパク質をそのまま観測できる点でアミロイドの構造研究には最適である.実際に,神経変性疾患の患者の脳から取り出したアミロイドでも,純度が高ければその構造は決定されており,現在ではアミロイド研究に必須の手法となっている(図3).
アミロイドはβシートにより形成されたタンパク質モノマーが規則正しく積層した構造を持つ.アミロイドの線維軸方向はβストランド間の主鎖の水素結合や側鎖の相互作用(芳香族側鎖のπ–π相互作用やpolar zipper)によって安定化されている16).クライオ電顕を中心とした構造研究により,多くのアミロイドタンパク質のさまざまな構造が明らかになり,そのアトラスができることで,各アミロイドの構造と性質との関係性や対比がより明確になりつつある.たとえば最近の計算の研究では,βストランドの形状によりアミロイドの可逆性が変化しうることが示唆されている16).ひとくちにβストランドといっても主鎖が形成する形はさまざまであり,アミロイドでは主に3種のβストランド構造が観測されている.液–液相分離の章でも紹介したTDP-43やFUS(fused in sarcoma)では可逆的に形成するような弱い構造のアミロイドを形成することがわかっている.これらのアミロイドはねじれたβストランド構造や伸び切った直線的なβストランド構造が豊富に含まれている.これらのβストランド構造は標準的な,不可逆なアミロイドを構成するひだ状のβストランド構造に比べるとエネルギー的に不安定であることがわかってきた.このように,アミロイドの構造を観測する手法が発達したことで,アミロイドの構造と性質との相関性が明らかになってきている.一方で,同じタンパク質でも環境の違いでさまざまなコンホメーションをとることも明らかになり(図3),いかにして「試験管内で,意味のある(生命現象に関連する)構造のアミロイドを均一に作り出すか」はクライオ電顕による構造解析においては重要な課題である.
一方で,クライオ電顕で明らかにされる構造がすべてではない.アミロイドの構造において,クライオ電顕で観察される部位はアミロイドのコア領域のみであることが多く,それは静的な構造でもあり,特定の決まった構造を持たない動的に揺らいでいる部位(fuzzy coatまたはflanking regionとも呼ばれる)はクライオ電顕では観測できない.しかし,その動的に揺らいでいる部分は機能性アミロイドにおいて生理的に重要な役割を担っている他,細胞にとって有害なアミロイドにおいてもシャペロンなどの細胞内因子や膜との結合に深く関与していると考えられている.そのため,アミロイドのコア構造と同様に,動的に揺らいでいるアミノ酸領域の構造解析は,アミロイドの性質を明らかにする上できわめて重要である.
こうした揺らぎ領域の構造を調べる研究は赤外分光法が有用であろうと考えられる.赤外分光法では,観察対象に赤外光を照射し,その透過光や反射光から分子構造を調べる手法である.赤外分光法で得られる赤外シグナルは,分子振動を反映しており,タンパク質の二次構造やアミノ酸側鎖の電子状態やプロトン化状態を鋭敏に反映する.X線結晶構造解析やクライオ電顕のように,タンパク質の三次元構造を明らかにすることはできないが,赤外シグナルの位置を示す振動数は原子間の結合強度(結合距離)を反映し,X線結晶構造解析でも観測できないような小さな構造変化も検出可能である.また,観測できる試料は粉末,乾燥フィルム,水溶液など制約がほとんどなく,さまざまな試料に柔軟に対応できる.測定アプリケーションも豊富で,時間分解測定によるタンパク質の動的構造解析や原子間力顕微鏡など他の手法との組合わせも行われている.実際にRuggeriらは,赤外分光法と原子間力顕微鏡を組み合わせて,アミロイドβの凝集阻害剤の分子メカニズムを明らかにしている17).
しかしながら,タンパク質の赤外シグナルは非常に弱く,それは水や水蒸気のシグナルによって埋もれてしまうために,一般的には,赤外分光の測定には高濃度(通常,mMレベル)のタンパク質試料が必要である.このことから,これまで,脱凝集反応にみられるような生理条件下(数μMレベル)での赤外分光測定は難しいとされていた.最近,野村らはそれを克服し,一般的な測定濃度から1000倍ほど低い数μMのタンパク質試料を用いて高いSN比で分子振動を測定できる時間分解赤外分光システムを独自に開発してきた.このシステムを用いることで,アミロイドの脱凝集過程を観察し,TIRFでは観測できなかった脱凝集反応中間体の存在を明らかにしている(野村ら,未発表).このように,赤外分光法ではクライオ電顕では観測できない凝集構造体を観測でき,高い精度で時間依存的なタンパク質の構造変化を解明できる可能性がある.重要なことに,液–液相分離によって生じるタンパク質の二次構造変化にはいまだ不明な点は多い.特に,液–液相分離の研究では,数μMのタンパク質で液滴形成を生じさせることが多く,mMレベルのタンパク質濃度が必要な通常の赤外分光装置では測定が困難である.つまり,そのような高濃度のタンパク質を用いてしまうと,液滴の構造を調べたいにもかかわらず不可逆に凝集体へとすぐに移行してしまう可能性が危惧される.したがって,液–液相分離現象の解明には,低濃度のタンパク質を用いて高いSN比で二次構造解析を行うための新たな技術開発は急務であり,このような時間分解赤外分光システムは今後の液–液相分離研究においても大きな貢献を果たすと期待される.
近年,クロマチンの制御やシナプスの可塑性を含むさまざまな生命現象に液–液相分離現象が関わることが見いだされている.本稿では疾患関連タンパク質を中心に,液–液相分離とその不可逆的な凝集形成への移行により生じるアミロイドの諸問題,特に未解明な問題が多く残されている脱凝集過程について概説した.今後,液–液相分離が実際に細胞の中でどのようなポジティブまたはネガティブな役割を果たしているのかを明らかにするため,生細胞や個体の中での液–液相分離の解析を行うことがより重要になってくると思われる.また,液–液相分離の過程や液滴の構造をより詳しく調べるための新規な技術開発は重要であろう.引き続き,再構成系のように試験管内できれいに液滴を作る研究はそのタンパク質の構造変化や生成・解離の制御機構を調べる上でも必須であり,今後このようなin vitroとin vivoの両方での研究の進展によって,液–液相分離現象の原理,生理的意義がより理解されることを期待したい.
引用文献References
1) Ohhashi, Y., Ito, K., Toyama, B.H., Weissman, J.S., & Tanaka, M. (2010) Differences in prion strain conformations result from non-native interactions in a nucleus. Nat. Chem. Biol., 6, 225–230.
2) Franzmann, T.M., Jahnel, M., Pozniakovsky, A., Mahamid, J., Holehouse, A.S., Nüske, E., Richter, D., Baumeister, W., Grill, S.W., Pappu, R.V., et al. (2018) Phase separation of a yeast prion protein promotes cellular fitness. Science, 359, 6371.
3) Suzuki, G., Shimazu, N., & Tanaka, M. (2012) A Yeast Prion, Mod5, Promotes Acquired Drug Resistance and Cell Survival Under Environmental Stress. Science, 336, 6079.
4) Suzuki, G., Weissman, J.S., & Tanaka, M. (2015) [KIL-d] Protein element confers antiviral activity via catastrophic viral mutagenesis. Mol. Cell, 60, 651–660.
5) Lin, Y., Zhou, X., Kato, M., Liu, D., Ghaemmaghami, S., Tu, B.P., & McKnight, S.L. (2020) Redox-mediated regulation of an evolutionarily conserved cross-β structure formed by the TDP43 low complexity domain. Proc. Natl. Acad. Sci. USA, 117, 28727–28734.
6) Kanaan, N.M., Hamel, C., Grabinski, T., & Combs, B. (2020) Liquid-liquid phase separation induces pathogenic tau conformations in vitro. Nat. Commun., 11, 2809.
7) Boyko, S. & Surewicz, W.K. (2022) Tau liquid-liquid phase separation in neurodegenerative diseases. Trends Cell Biol., 32, 611–623. doi: 10.1016/j.tcb.2022.01.011.
8) Wegmann, S., Eftekharzadeh, B., Tepper, K., Zoltowska, K.M., Bennett, R.E., Dujardin, S., Laskowski, P.R., MacKenzie, D., Kamath, T., Commins, C., et al. (2018) Tau protein liquid–liquid phase separation can initiate tau aggregation. EMBO J., 37, e98049.
9) Tanaka, M., Collins, S.R., Toyama, B.H., & Weissman, J.S. (2006) The physical basis of how prion conformations determine strain phenotypes. Nature, 442, 585–589.
10) Tittelmeier, J., Sandhof, C.A., Ries, H.M., Druffel-Augustin, S., Mogk, A., Bukau, B., & Nussbaum-Krammer, C. (2020) The HSP110/HSP70 disaggregation system generates spreading-competent toxic α-synuclein species. EMBO J., 39, e103954.
11) Shorter, J. & Lindquist, S. (2004) Hsp104 catalyzes formation and elimination of self-replicating Sup35 prion conformers. Science, 304, 1793–1797.
12) Nakagawa, Y., Shen, H.C., Komi, Y., Sugiyama, S., Kurinomaru, T., Tomabechi, Y., Krayukhina, E., Okamoto, K., Yokoyama, T., Shirouzu, M., et al. (2022) Amyloid conformation-dependent disaggregation in a reconstituted yeast prion system. Nat. Chem. Biol., 18, 321–331.
13) Gao, X., Carroni, M., Nussbaum-Krammer, C., Mogk, A., Nillegoda, N.B., Szlachcic, A., Guilbride, D.L., Saibil, H.R., Mayer, M.P., & Bukau, B. (2015) Human Hsp70 disaggregase reverses Parkinson’s-linked α-synuclein amyloid fibrils. Mol. Cell, 59, 781–793.
14) Wentink, A.S., Nillegoda, N.B., Feufel, J., Ubartaitė, G., Schneider, C.P., De Los Rios, P., Hennig, J., Barducci, A., & Bukau, B. (2020) Molecular dissection of amyloid disaggregation by human HSP70. Nature, 587, 483–488.
15) Schneider, M.M., Gautam, S., Herling, T.W., Andrzejewska, E., Krainer, G., Miller, A.M., Trinkaus, V.A., Peter, Q.A.E., Ruggeri, F.S., Vendruscolo, M., et al. (2021) The Hsc70 disaggregation machinery removes monomer units directly from α-synuclein fibril ends. Nat. Commun., 12, 5999.
16) Murray, K.A., Evans, D., Hughes, M.P., Sawaya, M.R., Hu, C.J., Houk, K.N., & Eisenberg, D. (2022) Extended β-Strands contribute to reversible amyloid formation. ACS Nano, 16, 2154–2163.
17) Ruggeri, F.S., Habchi, J., Chia, S., Horne, R.I., Vendruscolo, M., & Knowles, T.P.J. (2021) Infrared nanospectroscopy reveals the molecular interaction fingerprint of an aggregation inhibitor with single Aβ42 oligomers. Nat. Commun., 12, 688.
著者紹介Author Profile
 野村 高志(のむら たかし)
野村 高志(のむら たかし)国立研究開発法人理化学研究所脳神経科学研究センター基礎科学特別研究員.博士(理学).
略歴2009年兵庫県立大学理学部を卒業し,14年同大学院生命理学研究科にて学位取得.理化学研究所放射光科学総合研究センター特別研究員,兵庫県立大学大学院特任助教を経て19年より理化学研究所脳神経科学研究センター特別研究員,20年より現職.
研究テーマと抱負タンパク質の形や動きから生命現象を理解することをテーマに研究しています.アミロイドにまつわる反応を分子レベルの動画として可視化し,その原理を明らかにすることを目指します.
趣味ボルダリング.
 田中 元雅(たなか もとまさ)
田中 元雅(たなか もとまさ)国立研究開発法人理化学研究所脳神経科学研究センターチームリーダー.博士(工学).
略歴1994年京都大学工学部を卒業し,99年同大学院工学研究科にて学位取得.理化学研究所,カリフォルニア大学サンフランシスコ校での博士研究員などを経て2006年理化学研究所にてユニットリーダー,11年より現職.
研究テーマと抱負本稿で紹介した生物物理学に加えて神経科学,各種オミクス解析のアプローチから精神・神経変性疾患の病態解明を目指しています.本研究内容に興味のある大学院生や博士研究員を募集中ですので,お気軽にお問い合わせください.
ウェブサイトhttp://motomasalab.riken.jp/
趣味スポーツ観戦.