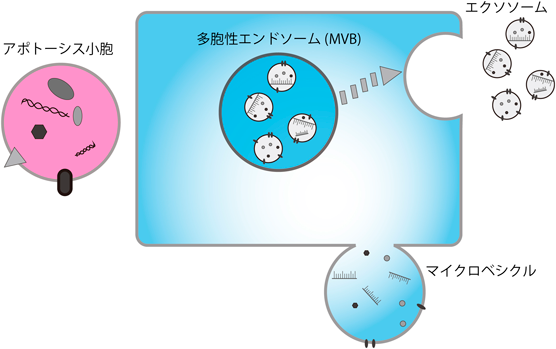
細胞は,脂質二重膜で囲まれたナノ~マイクロサイズの粒子=細胞外小胞(EVs)を分泌する.EVsにはタンパク質や核酸などの生理活性を持つ機能性分子が含まれており,これらの分子を細胞から細胞へと運ぶ役割を持つ.EVsにはそのサイズ,構成物質の種類によってさまざまな粒子が存在する.EVsの分類に関する定義についてはあいまいなところも多いが,生成機構にもとづいた分類ではエクソソーム,マイクロベシクル,アポトーシス小胞が知られている(図1).EVsに内包,または膜に存在する核酸やタンパク質などの分子の量・種類は細胞の種類・状態により大きく変動することから,疾病のバイオマーカーとして有効であると同時に,新たなドラッグデリバリーシステムとして創薬開発分野でも注目されている.がんや神経変性疾患において,その病気の進行とEVsには深い関係がある2).ある種のがん細胞から分泌されたEVsに含まれる分子には,血管新生の誘導や細胞の形質転換を引き起こす作用があり,がん微小環境の形成やがん転移の臓器特異性を決定づける因子が含まれている3).また,神経変性疾患では,プリオンやアミロイドβペプチドなど原因タンパク質の異常な凝集体が,EVsによって周囲の細胞へと伝播する4).このようにEVsは細胞間の情報伝達物質の運び手として,我々の生命活動にさまざまな影響を与えていることが明らかになってきた.
多様性が知られるEVsの解析において,EVs共通マーカーとして最も利用されている分子の一つがテトラスパニンファミリーに属するCD63である.CD63は4回膜貫通領域を持ち,細胞表面および細胞内小胞に局在し,細胞活性化,接着,分化,がん細胞浸潤などに重要な役割を持つ.CD63は血小板の活性化に伴って血小板表面での発現増加が認められ,CD63欠損はHermansky–Pudlak症候群の原因の一つと考えられている5).これまでCD63の発現調節機構についてはほとんど明らかにされていなかった.筆者らは,鉄濃度依存的な細胞内変化を解析する過程において,CD63が鉄により制御を受けることを新たに見いだした1).CD63の鉄濃度依存的な発現制御機構については,3章2)節で詳細を記述する.
3. IRE-IRPシステムを介した細胞内鉄依存的発現制御機構
1)細胞レベルでの鉄制御機構
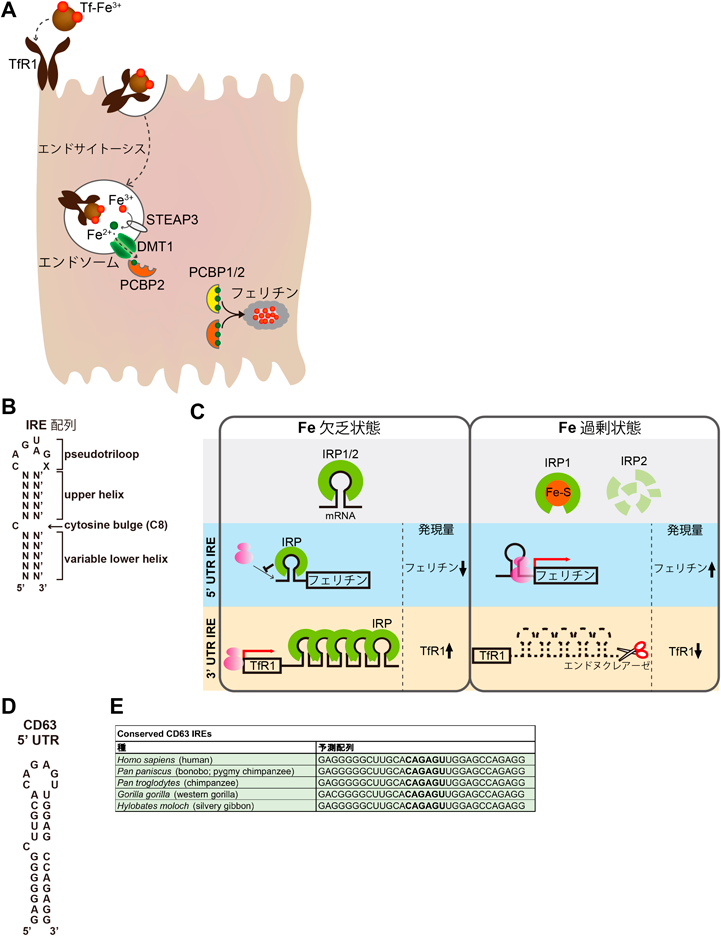
鉄はすべての生物に必須の微量金属であり,酸素輸送,エネルギー産生,DNA合成など生物の根源を支える数百のタンパク質や酵素の必須成分である.血中で鉄のキャリア分子として機能するトランスフェリン(Tf)は,2分子の三価鉄と結合して血中を循環する.鉄を保持したHolo-Tfが細胞表面に発現するTf受容体(TfR1)に結合すると,エンドサイトーシスにより細胞内へと取り込まれる.エンドソーム内でpHが酸性になるとTfから鉄が外れ,鉄還元酵素STEAP3(six-transmembrane epithelial antigen of the prostate 3)によって二価鉄に還元されたのち,二価鉄輸送体DMT1(divalent metal transporter 1)を介して細胞質内へと輸送される.二価鉄はDMT1によって細胞質に放出されると同時に鉄シャペロン分子PCBP2[poly(rC)binding protein 2]に捕捉され6),そのオルソログ分子であるPCBP1とともに鉄を必要とする分子へと輸送される.細胞内の鉄が増えると,余剰な鉄を貯蔵するために鉄貯蔵タンパク質フェリチンが速やかに産生され,PCBP1/2が過剰鉄をフェリチンへと輸送する(図2A).
過剰鉄は活性酸素(ROS)産生の触媒として作用し,近年発見された鉄依存的な制御性壊死=フェロトーシスを引き起こす7).そのため細胞は鉄レベルを一定に保つ必要があり,iron responsive element(IRE)–iron regulatory protein(IRP)システムを介して鉄濃度依存的に,鉄の取り込み・排出・運搬に関わる分子のmRNAの転写後調節を行う8).IREは5′または3′非翻訳領域(UTR)に存在し,5′-CAG(U/A)GX-3′という共通の6塩基ループとステム構造からなる(図2B).
TfR1やフェリチンは,IRE–IRPによる発現制御を受ける代表的な分子である.RNA結合タンパク質であるIRPは,鉄欠乏下においてのみIREに選択的に結合することで,その制御下にある分子の発現量を調節する9)(図2C).IRP1は二つの機能を有したタンパク質であり,細胞内鉄濃度が高いときは,IRP1に鉄–硫黄クラスターが結合して細胞質アコニターゼとして働く.一方,鉄欠乏時には鉄–硫黄クラスターが外れて,IRE結合タンパク質として機能する.IRP2はIRP1と異なり,IRE結合タンパク質としてのみ機能する.細胞内鉄濃度が高いとIRP2はFBXL5(F-box and leucine rich repeat protein 5)を介したユビキチン−プロテアソーム系で分解され,鉄欠乏時にのみIRE結合活性を示す.
フェリチンのIREは5′ UTRに一つ存在する.鉄欠乏状態では,IREにIRPが結合するためフェリチンmRNAへのリボソームの結合が阻害され,mRNAが存在してもフェリチンタンパク質が翻訳されず発現が抑制される.逆に鉄過剰状態では,IRPがIREから外れて翻訳が進むことで過剰鉄を貯蔵するフェリチンタンパク質が産生される.
これに対し,TfR1には3′ UTRに五つのIREが存在する.鉄欠乏時にはIRPがIREに結合することでTfR1 mRNAの安定性が高まり,タンパク質の発現が増加する.一方,鉄過剰時にはIRPがIREから外れ,TfR1 mRNAがエンドヌクレアーゼによって分解されることで,タンパク質の発現量が減少し,鉄の細胞内取り込みが抑制される.これまでにIREを非翻訳領域に持つ遺伝子として鉄代謝に関わる約10種類の分子が同定されており,IRE–IRPシステムにより細胞レベルで鉄制御が厳密に行われる機構が報告されてきた.
2)鉄によるCD63発現制御機構
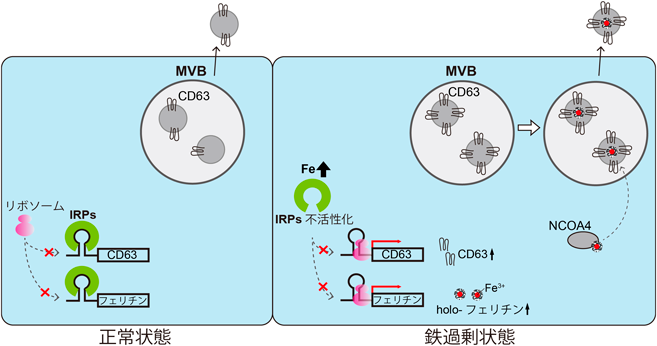
細胞に鉄を加えると,IRE-IRPシステムによって鉄代謝関連分子の発現が制御され,「鉄取り込みの抑制」,「鉄貯蔵能の亢進」,「鉄排出の促進」が誘導され,細胞内鉄濃度が一定に保たれる.CD63は,細胞への鉄投与時に発現が亢進し,逆に鉄を取り除くキレート剤投与時には発現が減少するという,フェリチンや鉄の排出輸送体フェロポーチンと同様の挙動を示した.また,CD63の発現誘導は,鉄負荷では観察されるものの亜鉛負荷ではみられない.EVsの共通マーカーとして知られるテトラスパニンファミリーのCD81は,CD63とともにバフィロマイシンAによるオートファジーの抑制で発現が亢進することが知られていたが10),CD81は細胞内鉄濃度にかかわらず一定の発現量を示す.バフィロマイシンA処理では,CD63, CD81は細胞内で同じ小胞に共局在するものの,鉄投与時には異なる局在を示すことから,これら二つの分子には異なる発現制御機構が存在することが予測された.そこで,CD63の鉄濃度依存的な発現制御機構を明らかにするために,CD63 mRNA上にIREが存在するかをSIRE(http://ccbg.imppc.org/sires/)を用いて予測したところ,ゴリラなど霊長類に保存されたIREをCD63の5′ UTRに見いだすことに成功した(図2D, E).
次に,予測されたRNA配列が真のIREとしてCD63の発現制御に機能するか否かを解析した.IRP1/2との結合能を解析したところ,IRP1/2ともにCD63 mRNAの5′ UTRに結合することから,鉄によってCD63の発現が制御されていることが予測された.さらに,IRP1/2の発現抑制によりCD63の発現が増加することが見いだされ,CD63がIRE-IRPシステムを介して鉄による発現制御を受けることが明らかとなった1).
4. CD63陽性小胞によるフェリチン分泌機構(図3)
血清中のフェリチンは,細胞内で産生分泌されたものであり,その量は体内の鉄量に応じて速やかに変動する.フェリチンには分泌シグナルが存在せず,小胞体–ゴルジの古典的分泌経路による分泌よりも,リソソームからの非古典的分泌経路をたどることが示唆されてきた11).フェリチンは重鎖(H鎖)と軽鎖(L鎖)のサブユニット24個で構成された外径12 nm,内腔形8 nmの球核状の巨大分子であり,フェリチン1分子あたり約4500もの鉄を三価鉄イオンの結晶構造として貯蔵することができる.血清中のフェリチンは鉄に乏しいことが知られており,分泌経路の詳細とともにフェリチン内の鉄の遊離機構についてはあまり詳細が明らかにされていない.
鉄投与時,細胞内CD63陽性小胞が増加し,その内部にフェリチンの蓄積を認めるようになる.2014年にフェリチン特異的なオートファジー=フェリチノファジーが発見され,フェリチンに蓄えた鉄の利用機序が明らかになった12).フェリチノファジーに欠かせない中心的役割を担うのがNCOA4(nuclear receptor coactivator 4)である.鉄需要が高まるとNCOA4はフェリチンH鎖に結合してリソソームへと輸送し,リソソーム内でのフェリチン分解に伴い鉄が放出されて利用可能となる.NCOA4のノックアウトにより,脾臓などにおいてフェリチンや鉄の蓄積を認めるようになるとともに,赤血球でのヘモグロビン合成が抑制され鉄欠乏性貧血を示す13).
細胞に鉄を負荷すると,NCOA4とCD63が共局在するようになり,EVs中のフェリチンが増加する.一方,NCOA4ノックダウン細胞では,鉄を投与後もCD63陽性小胞内のフェリチンは少なく,EVsによって細胞外へと分泌されるフェリチン量も減少した.すなわち,NCOA4を介したフェリチノファジー経路の一部は,CD63陽性小胞分泌経路と融合することで,過剰鉄を細胞外へと分泌している可能性が示唆された1).最近,NCOA4/フェリチン凝集体が,TAX1BP1(Tax1 binding protein 1)により,直接オートファゴソームやエンドソームに取り込まれる機構が明らかになった14).EVsを介したフェリチン分泌経路にも同様の機構が働いている可能性があり,今後のさらなる解析が望まれる.
これまでの報告から,CD63ノックアウト細胞ではEVsの分泌減少が観察されている.また,鉄投与によってCD63の発現が増加すると,特に100 nm以下のEVs分泌が増加し,フェリチンの分泌も増加することが観察された.細胞内の鉄量が増加したときに,鉄排出輸送体フェロポーチンに乏しい細胞では,フェリチンにより過剰鉄を貯蔵するとともに,TfR1の発現を制御することで細胞内への鉄取り込みを抑制し,鉄過剰に対応すると考えられてきた.EVsに含まれるフェリチンは,細胞内フェリチンと同様に鉄を保持している.今回NCOA4/フェリチン-CD63陽性小胞を介した分泌経路により,過剰鉄を排出する新たな機構が存在することが示唆された.
また筆者らはEVsの分泌・取り込みを介してEVsに含まれるフェリチンが近隣細胞へと輸送されることを明らかにした15).マクロファージがフェロトーシスにより細胞死を起こす過程に産生するEVsにはフェリチンが多く含まれる.このEVsを取り込んだ近隣細胞では,鉄を介したDNA傷害が増加した15).EVsのフェリチンは,単に細胞内鉄排出の一端を担うだけでなく,EVsを介したシグナル伝達やDNA傷害の誘発に重要な因子であることが示唆された.
細胞の鉄取り込み,排出はいずれも二価鉄輸送体が担う経路が広く知られていた.今回の解析により,EVsを介したフェリチン分泌が新たな鉄の排出・取り込みに関与する経路として機能していることが示唆された.EVsの形成・分泌機構は多様であり,現在もその機構についての新しい発見が相次いでいる.鉄過剰時には,比較的小さなEVsが多く観察されるようになることから,フェリチンを含む特異的なEVsの産生・分泌経路が存在する可能性がある.また,血清中フェリチンは鉄を持たないが,EVs中のフェリチンは鉄を保持しており異なる性質を示す.これら2種類のフェリチンの産生機構の違いについても,さらなる解析が望まれる.
EVsががんの悪性化,神経変性疾患の進行に重要な役割を担うように,EVs内に含まれるフェリチンが鉄を伝播することで,細胞傷害,ROS産生に寄与することが明らかとなった.EVs内にはさまざまな分子が含まれていることがすでに多く報告されている.個々の分子の機能解析,伝播機構の解明が進むことで,疾病の誘発・進行に寄与する新たなメカニズムが明らかになることが期待される.