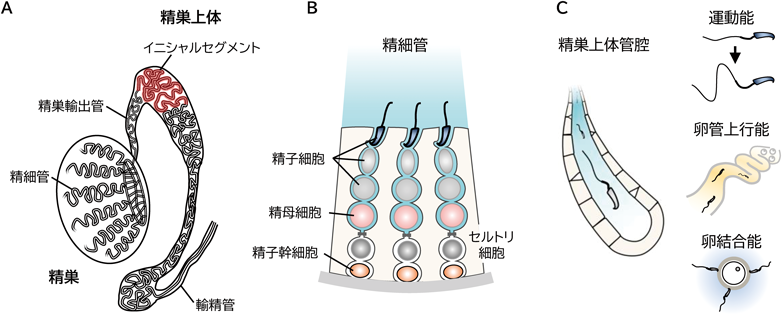
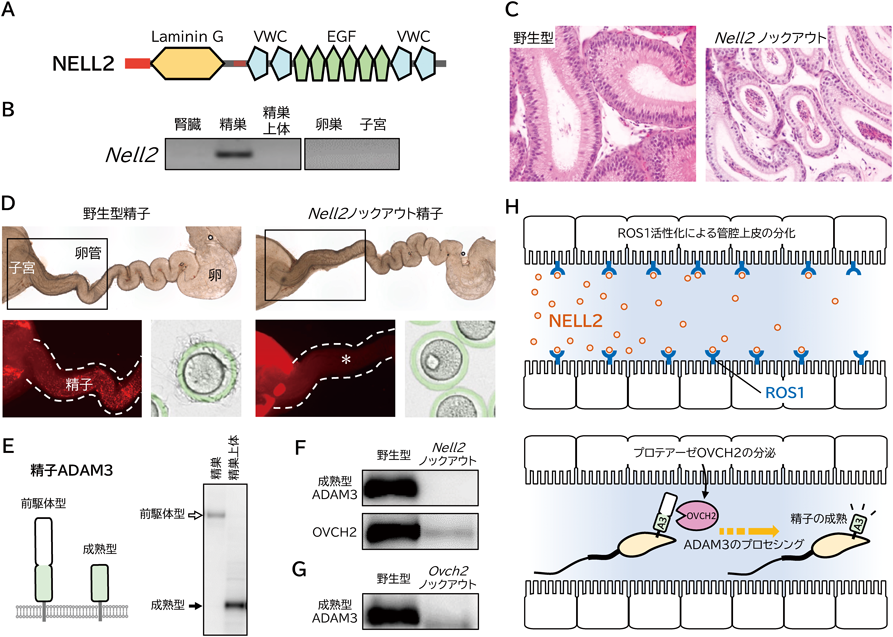
精子の成熟機構をオンにする分子「NELL2」―ルミクリンシグナル伝達機構の解明Regulation of sperm maturation by lumicrine signaling mediated by secreted protein NELL2
1 大阪大学微生物病研究所遺伝子機能解析分野Department of Experimental Medicine, Research Institute for Microbial Diseases, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘3–1 ◇ 3–1 Yamadaoka, Suita, Osaka 565–0871, Japan
2 科学技術振興機構戦略的創造研究推進事業さきがけPRESTO sakigake ◇ 〒102–0076 東京都千代田区五番町7 K’s五番町 ◇ 7 Gobancho, Chiyoda-ku, Tokyo 102–0076, Japan