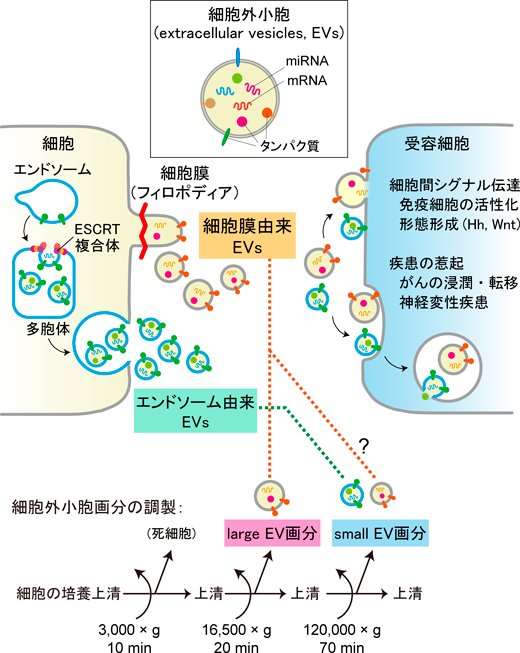
細胞外小胞は,細胞から分泌される脂質二重膜からなる小胞であり,種々のタンパク質やmiRNA等の核酸を内包する2).分泌された細胞外小胞は,周辺の細胞や,血流等を介して到達する遠隔の細胞に取り込まれ,内包する分子の作用を介して,たとえば免疫細胞の活性化や発生における形態形成シグナル伝達等の,細胞間シグナル伝達に関与する3).また,胚性幹細胞(ES細胞)が幹細胞性を保つために,ES細胞由来の細胞外小胞が関与するとの報告もある4).さらに細胞外小胞は,がんや神経変性疾患などのさまざまな疾患にも関与することが報告されている5).特にがん細胞は,細胞外小胞を多く分泌し,がんの悪性化に関与することが示唆されてきた.がん細胞が分泌する細胞外小胞は,がん特異的な分子を含んでおり,細胞の増殖・浸潤や血管新生を促進するとともに,がん特異的な組織への転移を促進することが示されている6).
細胞外小胞は遠心分離による分画で,直径50~150 nmのsmall EV(s-EV,またはエクソソーム)と,直径50~1000 nmのlarge EV(l-EV,またはマイクロベシクル)に主に分類される2, 7)(図1).s-EVはエンドソームに由来し,l-EVは細胞膜に由来すると大まかに理解されることが多いが,形成機構と細胞外小胞の大きさの対応は1対1ではなく,主に遠心分離に由来するあいまいさを多く含んでいる.このうち,エンドソーム由来の細胞外小胞については,その形成・分泌の分子メカニズムが,これまでに詳しく研究されてきた2).エンドソーム膜がendosomal sorting complex required for transport(ESCRT)複合体やスフィンゴミエリナーゼ8)の作用により陥入すると,内部に多数の小胞を有する多胞体が形成される.そして,多胞体が微小管を介して細胞膜に運ばれ,細胞膜と融合することにより,内部の小胞が細胞外小胞として分泌される.一方,細胞膜由来の細胞外小胞は,細胞膜から突出膜が形成され,それが切断されることにより分泌されるとされてきたが,突出膜の形成・切断を伴う細胞外小胞分泌の分子機構については,低分子量Gタンパク質Arf6,ホスホリパーゼD,アクトミオシンの収縮等が関与することが報告されていたものの9),エンドソームの関与する小胞と比較するとわずかな報告しかなかった.
3. BARファミリータンパク質による脂質膜の変形作用
細胞膜を含む脂質膜の変形には,Bin Amphiphysin Rvs(BAR)ファミリータンパク質が関与することが知られている10).BARファミリータンパク質は三日月形の二量体を形成し,正電荷クラスターを介して,ホスファチジルセリンやイノシトールリン脂質等の負電荷を有する脂質を含む脂質膜に結合する.そして膜上で多量体を形成することにより,脂質膜の形態を変化させる.BARファミリータンパク質は主に三つのサブファミリーに分類される.このうち,(N-)BARタンパク質,F-BARタンパク質は凹面に正電荷クラスターを持ち,細胞膜においてクラスリン被覆小胞やカベオラなどの陥入構造を形成し,エンドサイトーシス等に関与する.これに対し,I-BARタンパク質は凸面に正電荷クラスターを持ち,細胞膜で突出構造を形成し,糸状仮足(フィロポディア)や葉状仮足(ラメリポディア)等の形成に関与する.
一方,BARファミリータンパク質は,脂質膜の変形に加え,脂質膜の切断にも関与することが報告された.脂質膜に結合し,かつ両親媒性ヘリックスを脂質膜に挿入するN-BARドメインタンパク質amphiphysinや,ENTHドメインを持つepsinは,脂質膜の小胞化とエンドサイトーシスに関与することが示された11).また,リポソームにN-BARタンパク質エンドフィリンが結合したチューブ状の脂質膜を,光ピンセットにより吸引することで外力を加えると,脂質膜はエンドフィリンタンパク質の結合に依存して切断された12).そして細胞においては,エンドフィリンによる陥入膜に微小管上のキネシンを介した外力が作用することで,エンドサイトーシスが促進された.このように,BARタンパク質による脂質膜チューブの切断は,外力により促進されることが示された.
4. フィロポディア切断による細胞外小胞l-EVの分泌
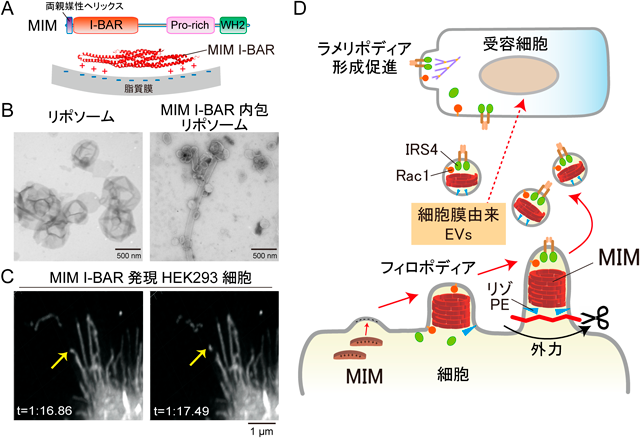
N-BARタンパク質が形成する陥入膜が外力で切断されるならば,I-BARタンパク質による突出膜も切断される可能性がある.そこで我々は,エンドフィリン同様に両親媒性ヘリックスを持つI-BARタンパク質missing in metastasis(MIM)が,突出膜の切断に関与するかを調べた1)(図2A).MIMの活性体であるI-BARドメイン(MIM I-BAR)の精製タンパク質をリポソームに内包させ,撹拌により外力を加えると,多数の小胞が形成された(図2B).なおMIMの膜への結合に関与する正電荷は膜小胞化に必須であったが,両親媒性ヘリックスは小胞化に関与していなかった.これは,MIMはエンドフィリンとは逆曲率である突出膜構造を誘導するため,脂質膜の間隙を広げて膜切断を促進する両親媒性ヘリックスの挿入の寄与が限定的になるためと考えられる.
次に,細胞においてMIMの局在する突出膜が切断されるかを調べた.MIM I-BARまたは全長のMIMを発現したHEK293細胞を細胞外基質に埋めて培養すると,MIM I-BARまたは全長MIM発現細胞ではフィロポディアが形成され,かつその周囲に小胞の分泌が観察された.一方,アクチン繊維の束化によりフィロポディアを形成するfascinタンパク質を発現した場合には,小胞分泌は,MIMに比べるとほとんど認められなかった.
そこで,理研BDR・清末優子先生との共同研究で,MIM I-BAR発現細胞を格子光ライトシート顕微鏡にて3次元でライブ観察したところ,MIM発現細胞のフィロポディアが切断されるようすが観察された(図2C).また,観察の際に顕微鏡の走査速度を上げることで細胞に外力をかけたところ,フィロポディアの切断頻度が増加した.したがって,MIMによるフィロポディア切断は,外力により促進されることが示唆された.
そこで次に,MIMによるフィロポディアの切断に必要な外力を測定した.奈良先端大・細川陽一郎先生,山田壮平先生との共同研究で,MIM発現細胞のフィロポディアにフェムト秒レーザーを照射し,フィロポディア切断に必要な外力を測定したところ,約10~15 kPaであることがわかった.毛細血管の圧力は4~13 kPaと報告されていることから,MIMによるフィロポディアが毛細血管の周囲で観察される程度の普遍的に存在する外力により切断されうることが示唆された.
次に,MIMを発現したHEK293細胞の無血清培養上清から,段階的な遠心分離により,細胞外小胞画分であるl-EV画分およびs-EV画分を調製した(図1).その結果,MIM I-BARおよび全長のMIMは,細胞膜由来の細胞外小胞が主に分布するとされるl-EV画分に多く分布していた.そこで,愛知がんセンター・小根山千歳先生との共同研究で,各小胞画分の粒子濃度を測定したところ,MIM I-BARおよび全長のMIMを発現した細胞のl-EV画分では,GFP発現細胞のl-EV画分と比較して粒子濃度が有意に増加した.一方,MIMノックダウン細胞から得られたl-EV画分では,粒子濃度が減少した.したがって,MIMは細胞膜すなわちフィロポディアに由来する細胞外小胞の形成を促進すると考えられた.なお,s-EV画分でも粒子濃度がMIMに依存する傾向がみられた.
次に,東大・青木淳賢先生,川名裕己先生,東北大・三枝大輔先生,かずさDNA研究所・池田和貴先生,理研IMS・有田誠先生との共同研究で,MIM I-BAR発現細胞から得たl-EV画分の脂質解析を行った.その結果,GFP発現細胞のl-EV画分と比べ,リゾリン脂質であるリゾホスファチジルエタノールアミンが多く含まれることがわかった.そこで,MIM I-BAR発現細胞をホスホリパーゼA2阻害剤ブロモエノールラクトンで処理することでリゾリン脂質の生合成を阻害したところ,l-EV画分の粒子濃度が減少した.したがって,脂質膜のリゾリン脂質が,MIMによる細胞外小胞形成を促進することが示唆された.リゾリン脂質は頭部と比べ脂肪酸尾部の容積が小さい逆コーン型をとるため,脂質膜の間隙が増加し,MIMによるフィロポディアの切断が促進されたと考えられた.
続いて,MIM依存的なl-EV画分に含まれるタンパク質の質量分析を行い,奈良県立医大・栗本一基先生と共同で解析した.その結果,MIMノックダウン細胞から得られたl-EV画分では,コントロール細胞のl-EV画分と比較してIRS4およびRac1が有意に減少することがわかった.IRS4はPI3キナーゼの活性化やコフィリンの脱リン酸化を介した細胞移動に関与し13),Rac1はラメリポディア形成を促進することが知られている細胞内シグナル伝達タンパク質である.
次に,MIMにより分泌される小胞が,受容細胞でラメリポディア形成や細胞移動を促進するかを調べた.まず,MIM I-BAR発現細胞のl-EV画分をHEK293細胞に添加すると,GFP発現細胞の場合と比較して,ラメリポディアを形成する細胞が増加した.次に,MIM I-BAR発現細胞のl-EV画分をHEK293細胞に添加し,細胞の動きを追跡したところ,GFP発現細胞のl-EV画分と比較して,細胞の移動速度が増加した.
これらの現象が,MIMに依存して分泌されるIRS4やRac1に起因するかを調べた.IRS4をノックダウンし,かつMIM I-BARを発現した細胞のl-EV画分では,MIM I-BAR発現細胞のl-EV画分と比較して,受容細胞におけるラメリポディア形成および細胞移動が減少した.一方,MIM I-BAR発現細胞のl-EV画分は,GFP発現細胞のl-EV画分よりも高いRac1活性を示した.そこで,MIM I-BAR発現細胞をRac1阻害剤EHT1864で処理した後,l-EV画分を調製して細胞に添加したところ,受容細胞の細胞移動が減少した.したがって,MIM依存的な細胞外小胞が内包するIRS4やRac1が受容細胞中で機能したと考えられた(図2D).ただし,IRS4やRac1が受容細胞でどのように機能するかは,現在のところ不明である.
さらに,MIM依存的な小胞の生理的役割を探るため,がん細胞の集団的移動への影響を創傷治癒(wound healing)アッセイにより調べた.すい臓がん細胞PANC-1の細胞層に傷を作った後,MIM I-BAR発現細胞から調製したl-EV画分を添加し,細胞の動きを追跡したところ,GFP発現細胞のl-EV画分と比較してPANC1細胞の移動速度が増加した.したがって,MIMにより分泌される小胞は,がん細胞の移動も促進することが示唆された.
本研究では,I-BARタンパク質MIMにより形成されるフィロポディアが弱い外力により切断され,細胞膜由来の細胞外小胞が形成されること,その切断が外力やリゾリン脂質により促進されることが明らかとなった.
また,MIM依存的なl-EV画分の小胞が内包するIRS4と活性化型Rac1が,受容細胞に取り込まれ機能することもわかった.このことは,フィロポディアに局在するシグナル分子が,MIMによる細胞外小胞に含まれ,直接に受容細胞に伝達されることを示唆する.しかし,MIMによる小胞の形成機構においては,MIMが活性化されフィロポディア形成や切断に至る分子機構は明らかでなく,IRS4やRac1などの積み荷分子の小胞への積極的な搭載機構も不明である.また,小胞の受容細胞への取り込み機構や,積み荷分子の受容細胞内での挙動も不明である.今後さらなる研究で,これらを明らかにすることが必要である.
MIM以外のI-BARタンパク質が小胞形成に関与する可能性もある.我々は,がん細胞からI-BARタンパク質IRSp53を介して分泌されるl-EV画分の小胞が細胞増殖を促進する現象を見いだしている(Hu, H.T. ら,投稿中).微絨毛はI-BARタンパク質IRTKSによって形成されるフィロポディア様の突起構造である14).興味深いことに,ハエのimaginal discの微絨毛が切断され,Hedgehog分子を有する小胞が産生されることが報告された15).このように,細胞突起の切断によって生じる細胞外小胞は,普遍的にみられる現象である可能性が高い.
一方,s-EV画分の小胞もMIMに依存傾向がみられたことから,フィロポディア切断により生じる小胞の大きさは広い分布を持つと予想され,l-EV画分だけでなくs-EV画分等にも分布する可能性がある.そのため,フィロポディア由来を含む細胞外小胞に特異的な分子と,よく調べられているエンドソームに由来する細胞外小胞の局在分子について,遠心分離やイメージングにおける挙動を比較検討し,細胞外小胞の形成機構,分子マーカー,積み荷分子,大きさなどを横断的に解析し,細胞外小胞の分類を確立することが急務である.すなわち,細胞外小胞の生化学的特性と形成機構の対応を明らかにすることが,依然として重要と思われる.これらの検証を通じて,細胞外小胞の分泌機構,生理作用,病態への関与の関連を明らかにし,治療や薬剤開発の手がかりを得られれば幸いである.