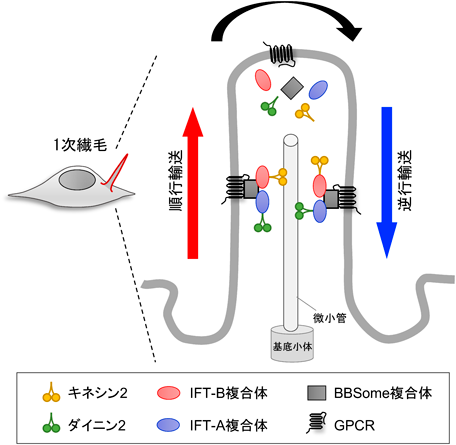
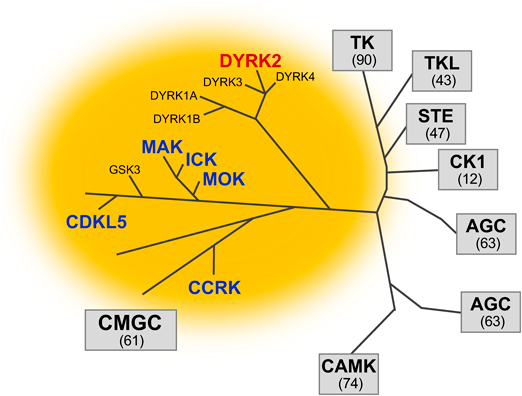
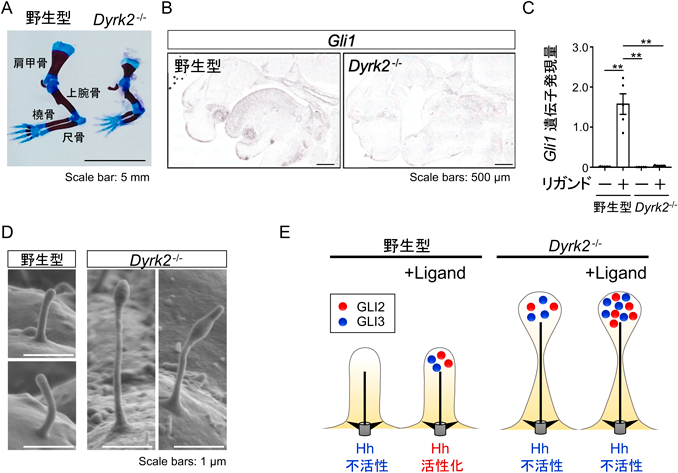
一次繊毛を介し組織発生を制御するCMGCキナーゼCMGC kinase regulates tissue development via primary cilia
東京慈恵会医科大学生化学講座Department of Biochemistry, The Jikei University School of Medicine, Tokyo, Japan ◇ 〒105–8461 東京都港区西新橋3–25–8 ◇ 3–25–8 Nishi-shimbashi, Minato-ku, Tokyo 105–8461, Japan