ポリコーム群タンパク質(PcG)は,ポリコーム複合体(Polycomb repressive complex:PRC)として作用し,特に分化・発生関連遺伝子群の転写抑制に重要な役割を担う.ポリコーム複合体は哺乳類ではDNA配列特異性がないが,CpGアイランドと呼ばれる保存性の高いCpGリッチな領域に集積し,ヒストンの翻訳後修飾などを介して転写抑制に寄与すると考えられている.哺乳類の遺伝子の50~70%程度がプロモーター領域にCpGアイランドを持つとされ,これには多くの分化・発生関連遺伝子が含まれる.
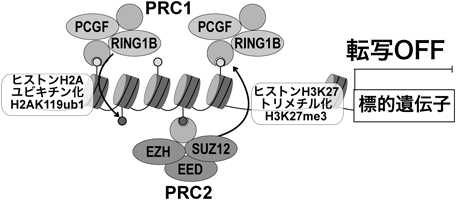
ポリコーム複合体はその構成因子によって大きくPRC1, PRC2の2種類に区分される(図1).PRC1とPRC2は標的とする遺伝子座に対してそれぞれが異なる修飾をヒストンに付加する役割を持つ.PRC1の活性中心因子であるRING1はヒストンH2Aの119番目のリシンにモノユビキチン(H2AK119ub1)を付加する活性を持ち,PRC2は活性中心因子のEZHがヒストンH3の27番目のリシンにトリメチル(H3K27me3)を付加する活性を持つ1).また,それぞれの複合体はさらにその抑制性ヒストン修飾を認識して結合する機能も有し,たとえばPRC1は構成因子であるCBXがクロモドメインによってH3K27me3を認識して結合し,PRC2はJARID2を介してH2AK119ub1に結合する2)ことが報告されており,PRC1とPRC2は互いに他方のヒストンの修飾を認識することで協調的に働き染色体上に集積していると考えられている.
ポリコームが結合する代表的な遺伝子として,発生で体軸を制御するHox遺伝子,各組織で特異的に発現する遺伝子(脳ではNeurog1など)などがあげられるが,これらの発生関連遺伝子を時期や領域特異的に抑制することで,その細胞に必要な遺伝子だけを発現できるように働いている.発生時期依存的な転写調節の例として,ES細胞ではニューロン分化に必要なSox4やSox11遺伝子はポリコームによって発現抑制状態にあるが,神経前駆細胞ではH3K27me3が外れて発現するようになる.このように,ポリコームは発生関連遺伝子の転写を一時的に抑制することで細胞の分化による遺伝子発現の変化を調節している.
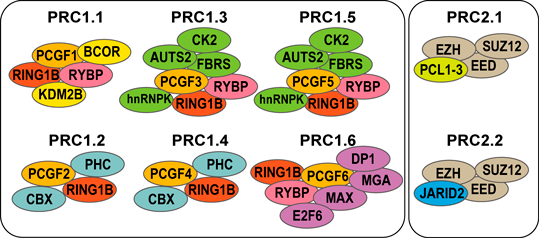
PRC1やPRC2はその構成因子によってさらに複数のバリアントに分類される(図2).PRC1は共通因子RING1と結合するPCGFファミリーの種類(PCGF1~6)によってPRC1.1からPRC1.6の6種類のサブタイプに分類され,それぞれ特徴的なコファクターを構成因子として含む3).PRC2も構成因子の違いによりPRC2.1とPRC2.2に分類され,機能的な違いがあることが示唆されている.
このようにポリコーム複合体には機能的に異なるさまざまなバリアントが存在するが,これらがどのようなシチュエーションで機能的な使い分けがあるのか,不明であった.
PRC1の活性中心因子であるRINGはES細胞で遺伝的に欠損させると標的遺伝子の脱抑制を引き起こす4).しかし,6種類のバリアントにそれぞれ固有に保持されるPCGF因子を単独で欠損させても,ポリコーム群複合体による転写抑制は大きな影響を受けないことが知られていた5).また,PCGF1~6をすべて欠損させるとRINGの欠損と同等に標的遺伝子の脱抑制を引き起こす.このことからそれぞれのPRC1バリアントは遺伝子抑制において補完的に働くことが示唆される.
一方,マウス個体においてそれぞれのPCGF因子を欠損させると,胚性致死,四肢の奇形などそれぞれのPCGFごとに異なる影響を生じる6, 7).このことから,それぞれのPRC1バリアントには発生や細胞分化の過程においては優位に働くシチュエーションがある可能性が考えられた.しかしそれぞれのPRC1バリアントがどのようにして細胞分化や発生に関わる遺伝子の転写制御に寄与しているのか,そのメカニズムについて多くは知られていなかった.
筆者らは最近,分化に伴った新規の遺伝子抑制ドメインの確立にはPCGF1を含むPRC1(PRC1.1)が重要であることを発見した8).
細胞分化や発生の際,分化先の細胞で必要になる遺伝子を新規にONにし,不要になる遺伝子を新規にOFFにするという転写状態の変化が起こる.筆者らはPCGF因子がこの転写状態の変化時に特異的に作用する可能性を考え,ES細胞から胚葉体(embryoid body:EB)に細胞分化を行ったときに「分化により新しく抑制される遺伝子」(つまりES細胞で発現していて,胚葉体になると抑制される遺伝子)に注目し,それぞれのPCGFを欠損させたときにこの抑制に影響を与えるか解析を行った.
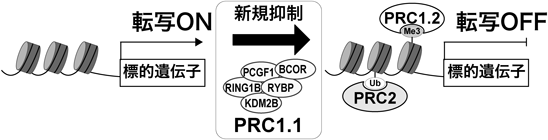
Pcgf1~6のそれぞれを欠損させたマウスES細胞を作製し,胚様体に分化させ,次世代シーケンサーを用いた網羅的遺伝子発現解析(RNA-Seq)を行ったところ,Pcgf1欠損ES細胞のみで「分化により新しく抑制される遺伝子」の転写抑制が十分に起こらないことを見いだした.次にPCGF1が新しく抑制される遺伝子の発現抑制にどのように寄与するのかを調べるために,胚様体への分化時に転写抑制されてくる遺伝子群におけるポリコーム群タンパク質の結合の変化を,クロマチン免疫沈降法(ChIP)で解析した.正常のES細胞では,胚様体への分化に伴い新しく抑制される遺伝子はポリコームの集積が起こるのに対し,Pcgf1欠損細胞ではPRC1.1だけでなくPRC2や他のPRC1の集積も大きく障害された.
細胞分化にはさまざまな環境刺激が加わり,環境刺激に依存した間接的な影響を捉えている可能性があった.そこで,細胞分化に伴う二次的な影響を排除し,より直接的にプロモーターの不活性化とポリコーム複合体の結合の関係を調べるために,人工的にサイレンシング(遺伝子発現の抑制)を起こす「ドキシサイクリン(Dox)誘導性遺伝子抑制システム」を独自に開発した.このシステムでは,ドキシサイクリン(Dox)誘導性マーカー遺伝子上の薬剤(Dox)応答性プロモーターの上流に,ポリコーム複合体への結合領域を組み込むことで転写不活性化に伴うポリコームの集積を誘導することができる.このシステムをPcgf1欠損マウスES細胞に導入し,薬剤誘導的にサイレンシングを起こしたところ,細胞分化で得られた知見と同様に,別のポリコム複合体であるPRC1.2やPRC2の結合量が大きく減少した.
このことから,ポリコーム複合体PRC1のサブタイプの一つであるPRC1.1(PCGF1複合体)は転写の不活性化に伴い,クロマチン状態が抑制状態に遷移する際に他のポリコーム複合体(PRC1.2とPRC2)の集積を促進する役割があることが明らかになった(図3).つまり,Pcgf1が分化により新しく抑制される遺伝子を作り出すのに重要であることが示された.
Pcgf1の欠損が発生や細胞分化に与える影響としては,Pcgf1をノックダウンしたES細胞を分化させると神経系への誘導に影響が出る9)ことや全身ノックアウトではE8前後で発生が止まってしまう8)こと,ゼブラフィッシュにおいてもPcgf1を欠損させると頭部が形成し終脳が形成されないこと10)などが報告されている.つまりPcgf1は細胞の定常状態ではなく,発生や分化というクロマチン状態が遷移するときに機能することが示唆され,これらのPcgf1欠損による表現型はPRC1.1が新規の抑制ドメインを作り出すことができないことによると考えている.
また,ポリコーム複合体にはポリコームによって修飾されたヒストン(H3K27me3, H2AK119ub1)を認識する機構があり,すでにポリコームが集積している場所にリクルートされる.すなわち細胞分裂などによってヒストン修飾が希釈(1回の分裂によって細胞のヒストン修飾は半分になる)されたとしても,修飾が残っていればポリコームは集まることが可能である.このことから定常状態の細胞では影響が小さいものであると考えられる.
しかし,修飾の入っていない場所にポリコームを新規にリクルートするためには別の分子機構が必要である.PRC1.1は非メチル化CpGに結合するCXXCドメインを有するKDM2Bを構成因子として持つ11).そのため,PRC1.1が最初に修飾を入れるきっかけになる要素であるのは合理的であるといえるだろう.また,新しく修飾を入れる遺伝子の選択性についてはいまだに明らかになっていないことが多いが,少なくともES細胞から胚様体への分化で新規に抑制される遺伝子にポリコームが集積するのは,積極的にポリコームがくることで抑制されるというよりは,プロモーターが不活性化することが引き金となりポリコームが集まってくるようである8, 12).
PRC1.1以外にもポリコーム複合体にはさまざまなバリアントがあり,さらにそれぞれがユニークな機能を有する.PRC1.2/1.4はクロモドメインを持つCBXや,クロマチンのコンパクションに関わるPHCなどを特徴的な構成因子として複合体を形成する.PRC1.3/1.5はリボヌクレオタンパク質を構成因子とし,RNA依存的にクロマチン上に結合することが示唆されている13).また,PRC1.6は配列特異的な転写因子であるMAXやMGAを構成因子とし,典型的なポリコームの標的とは異なる遺伝子座にもポリコームをリクルートする6).
さらにPRC1バリアントにもさらにホモログが存在する.これらのホモログすべての組合わせが可能だとすると,約180通りもの種類のポリコーム複合体が存在することになる.たとえば,PRC1.2やPRC1.4の特徴的構成因子であるPHCにはPHC1, PHC2, PHC3がある.また,CBXにもCBX2, CBX4, CBX6, CBX7, CBX8があるが,それらは機能的ドメインの有無によって異なっており,同じバリアントに区分されるポリコームの複合体の中でもさらに性質が異なる可能性がある.しかし,ポリコームの数多くの構成因子がどのように制御されるか,どのような特徴的な機能があるかはいまだに明らかになっていないことが多い.これらのポリコーム複合体の構成因子を切り替えるメカニズムとして考えられるものとして,それぞれのポリコーム群タンパク質自体の遺伝子発現があげられる.一部の構成因子は細胞種ごとに発現パターンが異なることが知られており,そのような因子は発現の高い細胞種で影響が出ることが多い.たとえばPCGF5は心臓で特に発現が高く,逆説的にES細胞を用いた心筋への分化誘導系でPcgf5を欠損させると心筋細胞への成熟が促進される14).また,Pcgf6はES細胞で発現が高い因子であるが,胚性線維芽細胞においてPcgf6をノックダウンし,山中4因子を用いてリプログラミングを行うとiPS細胞へのリプログラミングが阻害されることも報告されている15).これらのことは細胞の性質を決定する上でそれぞれの細胞種特異的なポリコーム群タンパク質が適切に発現することの重要性を示唆している.