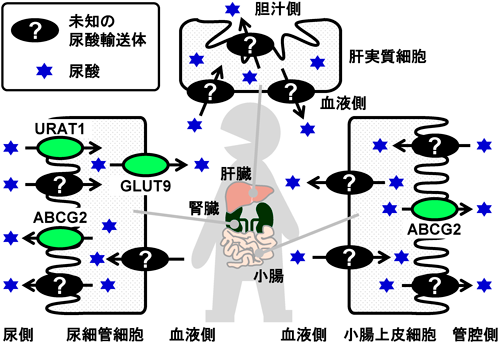
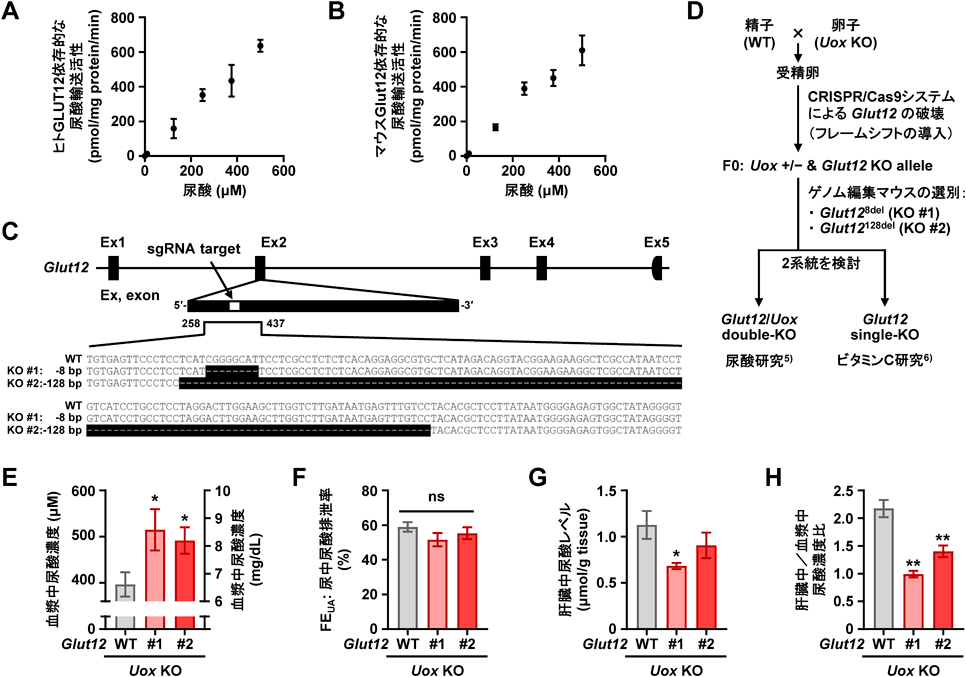
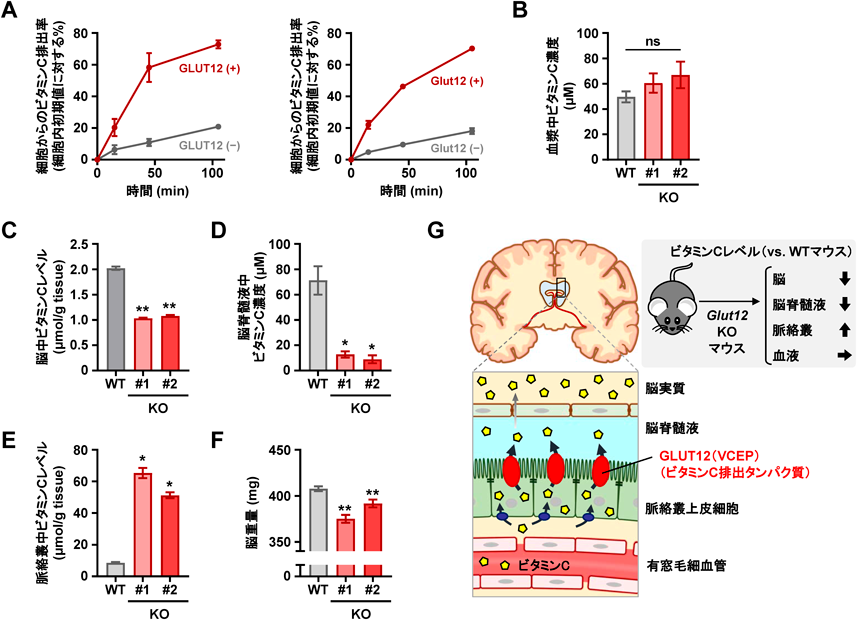
GLUT12の生理的重要性—尿酸の体内動態制御および脳へのビタミンC供給の観点からPhysiological importance of GLUT12—dual functions in the regulation of urate handling and vitamin C supply into the brain
東京大学医学部附属病院薬剤部Department of Pharmacy, The University of Tokyo Hospital ◇ 〒113–8655 東京都文京区本郷7–3–1 ◇ 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–8655, Japan