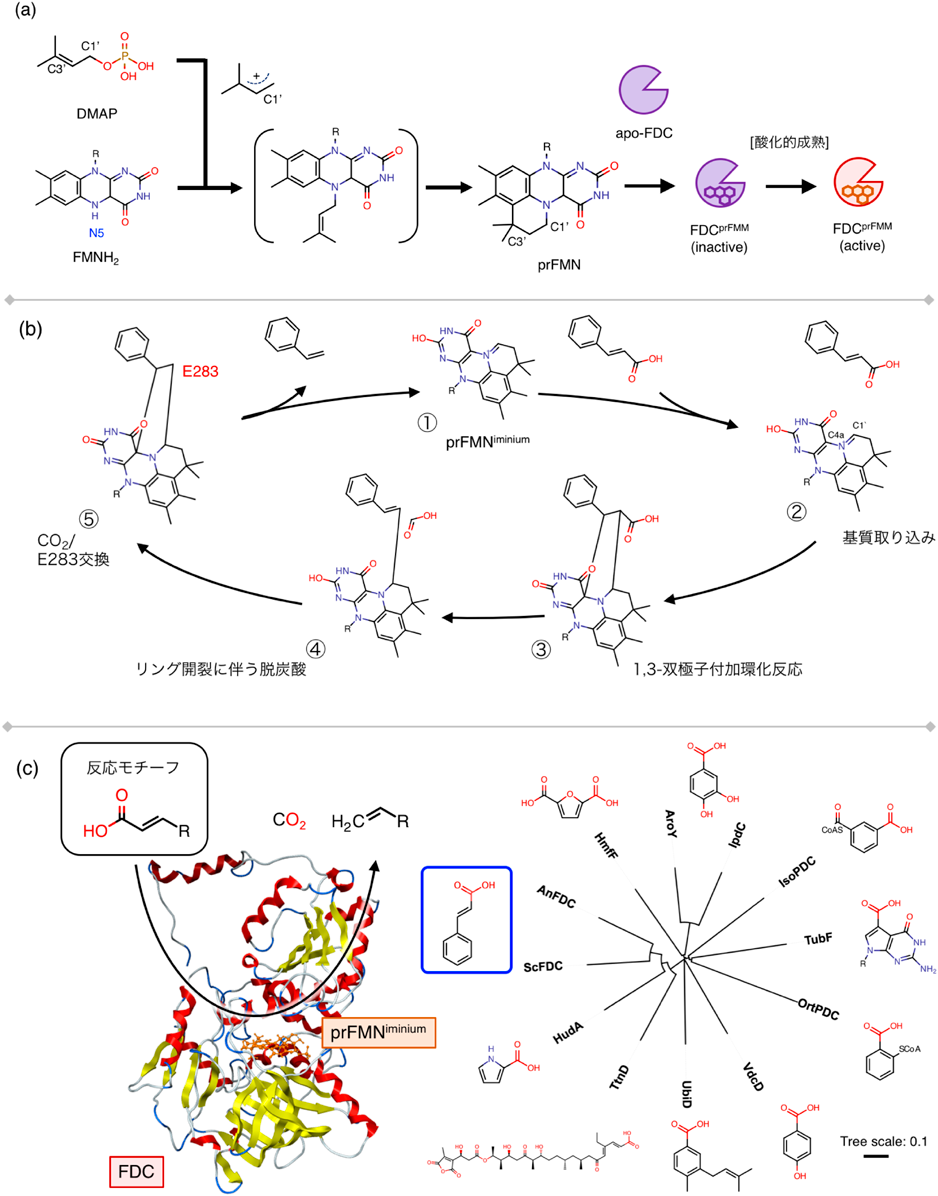
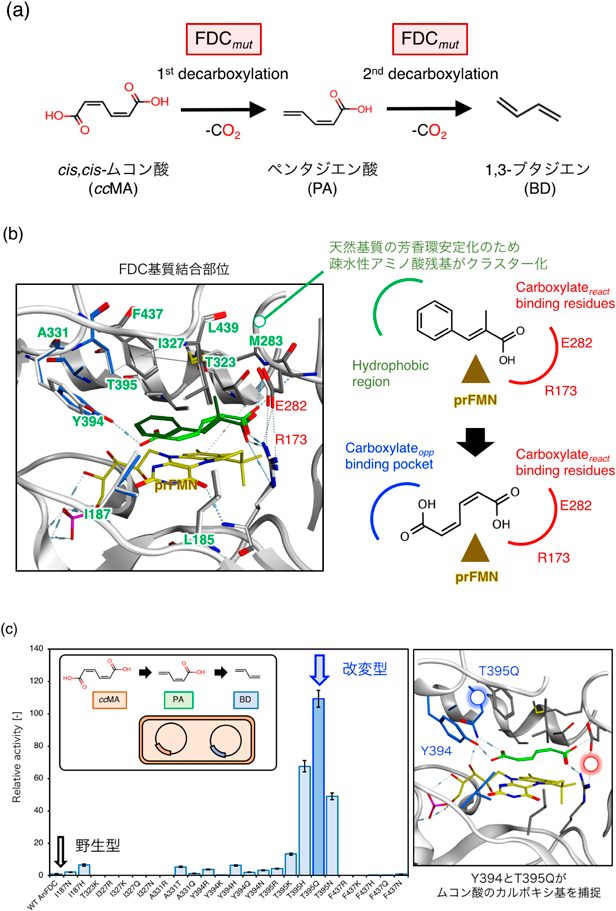
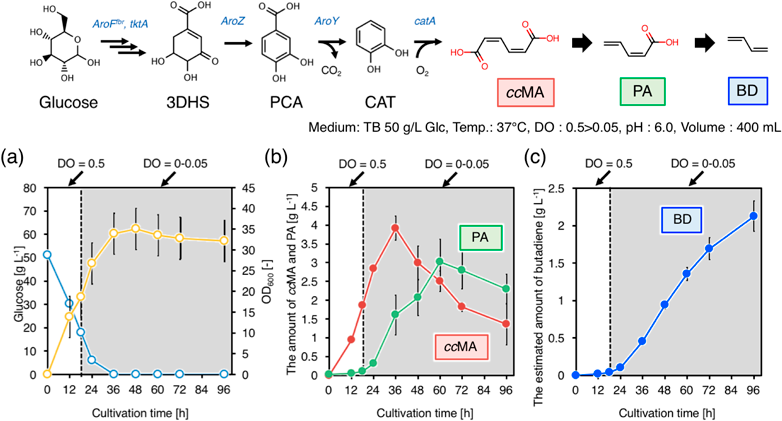
フェルラ酸脱炭酸酵素の合理的な基質特異性改変による1,3-ブタジエン生産Direct bioproduction of 1,3-butadiene by the tailor-maid ferulic acid decarboxylase mutant
1 特定国立研究開発法人理化学研究所環境資源科学研究センターCenter for Sustainable Resource Science, RIKEN, Yokohama, Japan ◇ 〒230–0045 横浜市鶴見区末広町1–7–22 ◇ 1–7–22 Suehirocho, Yokohama shi, Tsurumi ku, Kanagawa, 230–0045, Japan
2 理化学研究所バトンゾーン研究推進プログラムCenter for Sustainable Resource Science, RIKEN, Yokohama, Japan ◇ 〒230–0045 横浜市鶴見区末広町1–7–22 ◇ 1–7–22 Suehirocho, Yokohama shi, Tsurumi ku, Kanagawa, 230–0045, Japan