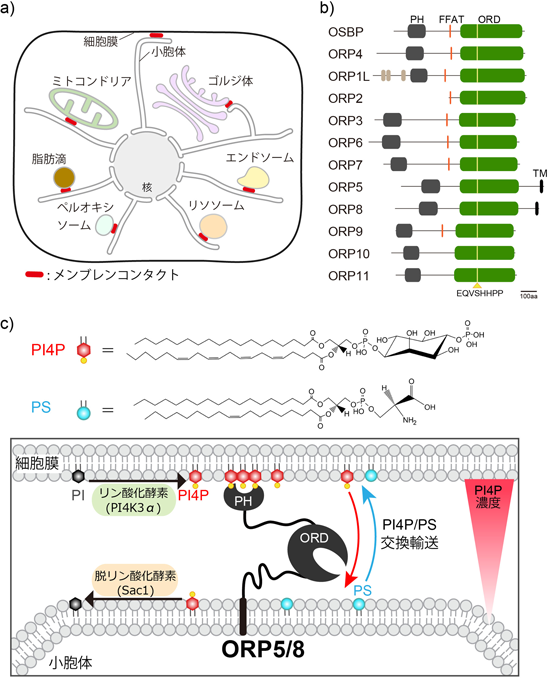
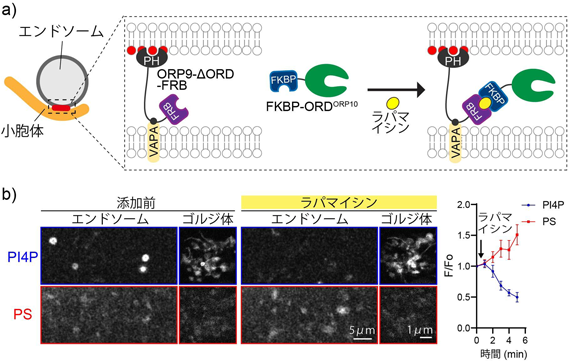
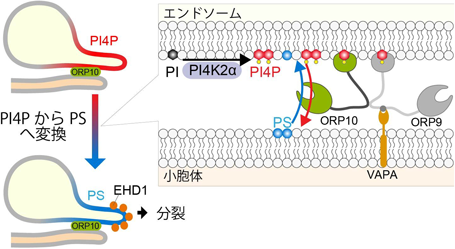
小胞体–エンドソーム間のメンブレンコンタクトにおけるPI4P駆動型脂質交換輸送PI4P-driven lipid countertransport at ER–endosome membrane contact sites
新潟大学大学院医歯学総合研究科Department of Neurochemistry and Molecular Cell Biology, Graduate School of Medical and Dental Sciences, Niigata University ◇ 〒951–8510 新潟市中央区旭町通1–757 ◇ 1–757 Asahimachi, Chuo-ku, Niigata 951–8510, Japan