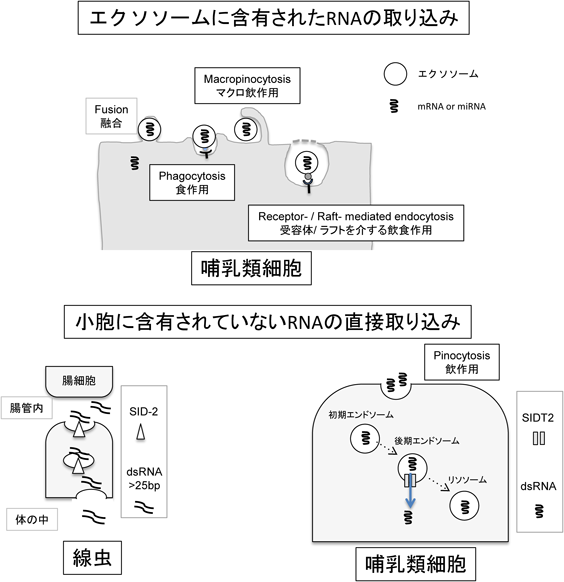
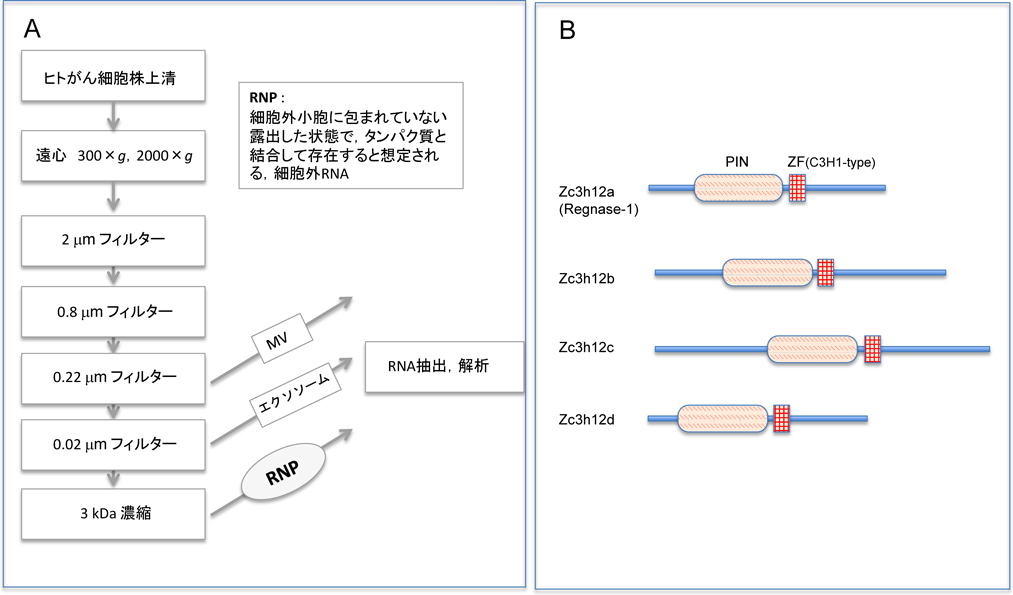
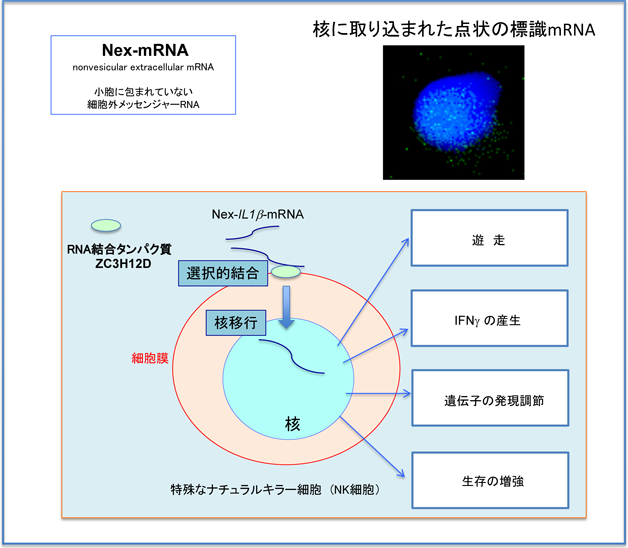
細胞外mRNAの核内への輸送と機能Biological function of extracellular mRNA
1 信州大学医学部分子医化学Institute for Biomedical Sciences, Interdisciplinary Cluster for Cutting Edge Research, Shinshu University, School of Medicine ◇ 〒390–8621 長野県松本市旭3–1–1 ◇ 3–1–1 Asahi, Matsumoto, Nagano 390–8621, Japan
2 信州大学先鋭領域融合研究群バイオメディカル研究所Department of Biochemistry and Molecular Biology, Shinshu University, School of Medicine ◇ 〒390–8621 長野県松本市旭3–1–1 ◇ 3–1–1 Asahi, Matsumoto, Nagano 390–8621, Japan