ミトコンドリアは細胞の代謝やエネルギー産生,あるいは恒常性維持に重要な細胞小器官であり,その異常はさまざまな疾患や老化に関与している.ミトコンドリアはプロテオバクテリアに由来すると考えられており,その構成成分は病原体を感知し排除しようとする自然免疫系のメカニズムによって細胞質内の異物として認識されやすい.特に異物としてのミトコンドリアDNAは細胞毒性が強く,メチル化状態,酸化的リン酸化機構に近接していることによる酸化修飾,環状構造,G4形成配列,あるいはサイズなどの特徴が核DNAとの区別に用いられているのかもしれない.近年ミトコンドリアの機能障害や構成異常によりミトコンドリアDNAが細胞質内に漏出し,自然免疫反応を引き起こすことを示唆する例が報告されつつある.我々はパーキンソン病モデルの培養細胞やゼブラフィッシュにおいて,ミトコンドリアDNAが細胞質へ漏出すること,漏出したミトコンドリアDNAはウイルスDNAセンサーとされるIFI-16によって検出され炎症反応を引き起こすことを報告した.ゼブラフィッシュパーキンソン病モデルでDNA分解酵素DNase IIを過剰発現させると,炎症反応および神経変性が抑制された.さらにヒトパーキンソン病患者の剖検脳においても細胞質内のミトコンドリアDNAやIFI-16の蓄積が認められ,病態との関連性が示唆された1).本稿では漏出ミトコンドリアDNA毒性がパーキンソン病の病態をどのように説明できるかを考えるとともに,ミトコンドリアDNAの漏出が惹起するさまざまな事例や経路を議論する.
2. パーキンソン病における漏出ミトコンドリアDNA
パーキンソン病は振戦,固縮,寡動などの運動障害や自律神経症状,精神症状などの非運動障害など多彩な症状を呈する神経難病である.パーキンソン病の病態仮説にはミトコンドリア機能障害やリソソーム機能障害などがあり,それらは生化学的な解析や遺伝学的な知見,あるいはMPTP(メチルフェニルテトラヒドロピリジン)などの毒物の作用メカニズムより支持されてきた.しかしパーキンソン病病態の詳細なメカニズムはまだまだ解明の余地を残している.
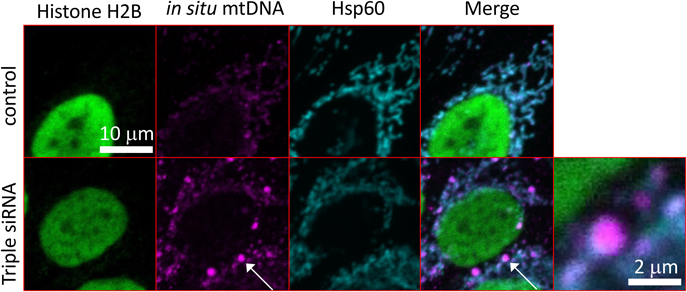
我々はパーキンソン病をモデルする培養細胞やゼブラフィッシュモデルにおいて,ミトコンドリアから漏出したミトコンドリア由来の二本鎖DNAが細胞質に存在することに着目した.もともと特殊な状況を除いて,このような細胞質の異所性のミトコンドリアDNAというのは非常に数が少ないために,その存在は染色方法などを工夫しないと同定は難しい.詳細な方法は論文を参照していただくとして,染色のバックグラウンドであったり,微生物由来のコンタミネーションによるDNAであったりを極力なくし,かつミトコンドリアDNAを感度よく染色する方法を選択する必要があった.そのようにしてコントロールでの異所性のミトコンドリアDNAが0に近い状態で,培養細胞においてパーキンソン病関連の遺伝子産物ATP13A2やGBAをsiRNAにより減少させたものを解析したところ,細胞質に小さな点状の二本鎖DNAの増加を認めた.この細胞質の二本鎖DNAは核由来のものとミトコンドリア由来のものが想定される.核由来のものであれば多くはヒストンと共局在するが,今回同定された異所性のDNAはミトコンドリアの外に存在し,かつヒストンと共局在しなかった.さらにこれらはミトコンドリアDNA配列を認識するプローブと結合することも明らかになった.つまり,細胞質の異所性のDNAはミトコンドリア由来の二本鎖DNAが細胞質に漏出したものであることがわかった(図1).
培養細胞において細胞質に漏出したミトコンドリアDNAが増加した状態は,I型IFN応答の上昇,切断型ガスデルミンDの上昇および細胞死を伴っていた.その培養細胞において不要になったDNAを分解する酵素であるDNase IIをあらかじめ過剰発現しておくと,これらの炎症反応や細胞死が抑制された.細胞質に漏出した核由来のDNAのセンサーとしてcyclic GMP-AMP synthase(cGAS)が脚光を浴びておりその下流ではSTINGが機能するが,細胞質に漏出したミトコンドリアDNAのセンサーは不明であった.我々はウイルスDNAのセンサーとして報告のあるinterferon gamma inducible protein 16(IFI-16)が,細胞質に漏出したミトコンドリアDNAのセンサーでもあることを明らかにした.このIFI-16をsiRNAにより減少させると細胞質に漏出したミトコンドリアDNAによる炎症反応が抑制された.またCRISPR-Cas9により作出したIFI-16のノックアウト(KO)細胞においても同様に細胞質に漏出したミトコンドリアDNAによる炎症反応は軽減した.
次いでパーキンソン病のリスク遺伝子であるGBAのゼブラフィッシュオルソログgbaのKOゼブラフィッシュを作出し解析した.gbaKOゼブラフィッシュは3か月でドパミン神経変性,行動異常を来すが,その脳内の細胞には野生型と比較して異所性のDNAが増加していた.このgbaKOゼブラフィッシュの脳内ではさらにcgas, stingやdnaseIIのmRNAの増加や炎症反応を認めた.そこでgbaKOゼブラフィッシュ神経細胞においてヒトDNase IIを過剰発現すると,異所性のDNAが減少し,ドパミン神経変性や行動異常の改善を認めた.
新潟大学脳研究所にはヒト剖検脳が高い品質で管理されている.我々は対照例とパーキンソン病の剖検脳をパラフィン切片およびウェスタンブロッティングなどで解析した.パーキンソン病の剖検脳切片ではミトコンドリアから漏出した二本鎖DNAの増加を認めた.さらに細胞質に漏出したミトコンドリアDNAに対するセンサーとして同定したIFI-16がウェスタンブロッティングでタンパク質レベルで増加していること,その蓄積がパーキンソン病の病変部位と一致していることを明らかにした.さらにIFI-16はパーキンソン病の病理の特徴の一つであるレビー小体と同じ分布を示した.
ミトファジーの研究で有名なRichard J. Youle博士の研究室は,Prkn −/−とPink1 −/−の両マウスにおいて運動負荷を課した場合,あるいはミトコンドリアDNAに変異を蓄積するmutatorマウスでPrkn −/−の場合,強い炎症反応が観察されることを報告している.この炎症所見は,Cgas等の下流で炎症反応などを制御するStingを欠損させることで軽減した.mutatorマウスでPrkn −/−の場合,老化により黒質のドパミン神経の変性と運動障害が観察されるが,それらもStingの欠損によって軽減した2).
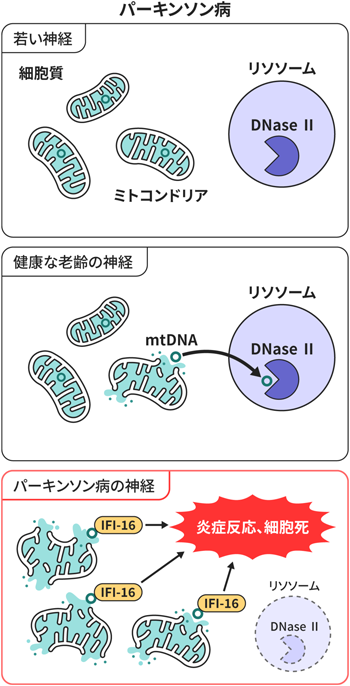
我々の結果およびYoule博士らの報告を含めた過去の文献より,ミトコンドリアDNAの細胞質への漏出がパーキンソン病の神経変性の重要な原因となる可能性が浮かび上がる1).かつてより存在するパーキンソン病の主要な病態仮説であるミトコンドリア機能障害やリソソーム機能障害とも矛盾しない.つまり障害を受けたミトコンドリアがオートファジーリソソーム系で分解されていれば問題は起きないが,その分解系のバランスが崩れミトコンドリアDNAが細胞質に存在するようになると,IFI-16およびSTINGを介した炎症反応や細胞死につながると考えられる(図2).今後はそれらの病態の詳細をさらに明らかにするとともに,他の臓器においても類似のメカニズムによる疾患が存在すると考え解析を進めていきたい.
ミトコンドリアDNAの細胞質への漏出は,ウイルスや細菌の感染時,あるいは疾患や環境因子による細胞ストレスによってミトコンドリアの代謝バランスが崩れミトコンドリア機能が欠損した場合にも観察される3).しかしミトコンドリア膜を通ってミトコンドリアDNAの漏出がどのように起こるかは,最近になってようやく少しずつ明らかにされ始めたばかりである.アポトーシスの活性化に伴うミトコンドリアDNA放出の場合では,ミトコンドリア外膜におけるBAX/BAKによるマクロポアの形成に続き内膜ヘルニアが起こりミトコンドリアDNAの漏出が起こる4).一方,酸化ストレス下では,ミトコンドリアDNAは電位依存性陰イオンチャネル(VDAC)のオリゴマー化を促進し,ミトコンドリア外膜にポアを形成しそこから放出される5).ミトコンドリアDNAが内膜を通過する機序の詳細は不明である.また必ずしもポアを通過する必要があるのかも定かではなく,ミトコンドリアが障害され形態をとどめなくなった際に受動的にミトコンドリアDNAが細胞質に漏出するケースもありうる.このようにミトコンドリアDNAの漏出の詳細なメカニズムは十分に解明されていない.
細胞質に漏出したミトコンドリアDNAを感知して自然免疫反応に至る経路は,ウイルスDNA感知とある程度共通している.現在までに主に三つの経路が報告されており,TLR9が感知する経路,NLRP3やAIM2センサーを含むインフラマソームが仲介する経路,cGASやIFI-16などのDNAセンサーによりSTINGを活性化する経路がある.これらの経路が活性化されると,I型インターフェロン,インターフェロン刺激遺伝子,炎症性サイトカインなどの炎症シグナルが,自己あるいは隣接する細胞の炎症反応をオートクラインあるいはパラクラインで活性化することによって増幅される.
cGAS-STING経路は,外来DNAや自身の細胞質DNAを感知して自然免疫反応を誘導すること,特に核から漏出したDNAを認識して細胞老化を惹起することなどから,近年のホットトピックスの一つである.一方で細胞質のミトコンドリアDNAの報告は核DNAに比べると少なかったが,近年増えてきている.細胞質のミトコンドリアDNAがcGAS-STING経路の活性化に関与することは,アポトーシス細胞において初めて報告された.アポトーシスではカスパーゼが活性化し,炎症性サイトカインは抑制されている.しかしこのカスパーゼを阻害すると,ミトコンドリアDNA依存的なcGAS-STING経路の活性化が惹起される6, 7).
ウイルス感染もミトコンドリアDNA漏出を引き起こす代表的な例である.ヘルペスウイルス感染はミトコンドリアDNA漏出を引き起こし,それが抗ウイルスシグナルとI型インターフェロン応答を増強することが報告されている8).インフルエンザウイルス感染によっても,ミトコンドリアDNA漏出が誘導され,cGASおよびDDX41依存性の自然免疫反応を刺激する9).代謝異常によるミトコンドリアDNA漏出の例も散見される.肥満によって脂肪組織においてミトコンドリアDNA漏出およびそれに伴うcGAS-STING経路の活性化が惹起され,炎症やインスリン抵抗性につながる10).コレステロール過多は,活性化マクロファージにおいてミトコンドリアDNAの漏出とAIM2インフラマソームの活性化を惹起する11).細胞のピリミジン欠乏によっても,ミトコンドリアDNA漏出およびcGAS-STING活性化が誘導される12).このように徐々にミトコンドリアDNA漏出の機序は明らかになりつつある現状である.我々が見いだしたミトコンドリアDNAセンサーIFI-16の詳細な機能解析を含め,さらなる発展が続くと思われる.
パーキンソン病ではミトコンドリアDNAの細胞質への漏出が炎症反応の重要な引き金となり,最終的に神経細胞死や運動障害につながる可能性を述べた.PINK1を介したマイトファジーがTNFにより阻害されると,ミトコンドリア機能低下と細胞質へのミトコンドリアDNA漏出をもたらしcGAS-STING経路を活性化することが最近報告されている13).本稿で記載したパーキンソン病態との関連がある可能性がある.パーキンソン病以外の神経変性疾患では,筋萎縮性側索硬化症においてTDP-43がミトコンドリアDNA漏出およびcGAS-STING活性化を誘導し,炎症を引き起こすことが報告されている14).
ミトコンドリアDNAセンサーの阻害と細胞質ミトコンドリアDNAの分解促進は,炎症反応とパーキンソン病あるいはその他の疾患の病態を改善するためのターゲットになりうる.今後の課題として,ミトコンドリアDNA漏出過程の詳細,複数のDNAセンサーの役割分担,ミトコンドリアDNA・クロマチンDNA・ウイルスDNAの違い,細胞種による違い,などがあげられる.脳のような複雑な組織では,さまざまな細胞種の代謝状態や老化過程の違い,および複雑な細胞間の相互作用があいまって,炎症の程度や病態を決定すると考えられる.ミトコンドリアDNAの細胞外への放出の可能性も考えなければいけない15).以上の研究が進むことで,パーキンソン病だけでなくさまざまな疾患の病態が明らかになることを期待したい.
謝辞Acknowledgments
本研究は脳研究所脳病態解析分野のスタッフや学生の皆様のご支援によりなされました.また共同研究を行っていただいた皆様,特に脳研究所病理学の伊藤絢子先生,柿田明美先生,武田薬品工業の松井英起様,田中麻衣子様には多大なご支援を賜りました.本研究は,AMED(助成番号JP22gm6110028 (H.M)), 日本学術振興会科研費(助成番号JP 22484842, JP 18955907(H.M))の助成を受けて実施したものです.心より感謝いたします.