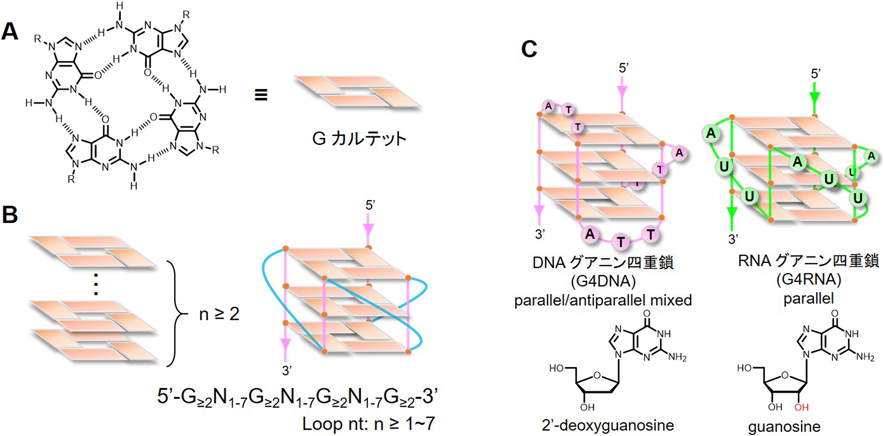
ゲノムDNA・RNA高次構造には多様性がある.DNAは,右巻き二重らせんであることがWatson博士とCrick博士によって1953年に発見された1).このDNAの基本的な構造は「B型DNA」と呼ばれている.実は,一般的に知られているこの右巻き二重らせん以外にも,左巻き(Z型)DNA,三重鎖(H型)DNAなど「非B型DNA」と呼ばれる構造が発見されており,DNAはその配列の特徴や溶媒の環境により右巻き二重らせん以外の構造を形成する2).非B型DNAの一つであるグアニン四重鎖(G-quadruplex:G4)構造は,グアニンが豊富な配列領域内の一本鎖DNAやRNAで形成される(各々G4DNA, G4RNAと呼ぶ)(図1).各グアニンが二つの隣接するグアニンと水素結合し,四つのグアニン分子が「Gカルテット」と呼ばれる正方形の平面配置をとる(図1A).さらにGカルテットは,互いの上に積み重なりG4構造を形成する.G4構造は,少なくとも二つの隣接グアニンを有する四つのトラクトと三つのループ領域で形成される(図1B).ループ長および配列の違いによりさまざまなG4DNAが形成される.これまで,G4DNAは分子内構造,二分子構造,四分子構造,高次Gカルテット構造,ストランドが同一の配向を持つパラレル型,4本のうち1本だけ逆を向くハイブリッド型,配向が2本ずつ交互になるアンチパラレル型などが報告されている.一方,G4RNAはループ長とは無関係にパラレル型を形成することが示されている.一例として,テロメアとテロメアRNA(TERRA)の構造を図1Cに示した.テロメアはTTAGGGの4リピート配列でハイブリッド型G4DNAを形成し,TERRAはUUAGGGの4リピート配列でパラレル型G4RNAを形成する3).ただし,上述のG4構造のトポロジー解析はすべてin vitroによる結果であり,この物理化学的性質がin vivoにおける生命現象にどのように関与するのかは未解明である.
G4構造はその物理学的に高い熱安定性やゲノム上の領域特性から,生体内での機能に注目が集まっている.たとえば,G4DNAはテロメア,有糸分裂および減数分裂の二本鎖切断部位,転写開始部位,複製起点において重要な役割を果たす4).さらに,G4RNAは,RNAスプライシング,RNA輸送,mRNA翻訳などRNA代謝の多くの段階に関与することが示唆されている5).これらの生物学的知見は哺乳類の胚性幹細胞など有糸分裂細胞で得られており,終末分化した神経細胞におけるG4構造の機能は明らかではない.
これまでの遺伝医学的な研究により,DNAのグアニンリッチ配列の伸長によるリピート伸長病においてG4構造の異常形成が神経疾患の発症に関与する可能性が示唆されている.中でも,C9ORF72遺伝子変異を起因とする筋萎縮性側索硬化症・前頭側頭葉変性症(C9ALS/FTD)の研究が最も盛んに行われている.C9ALS/FTDでは,C9ORF72遺伝子非翻訳領域内にヘキサヌクレオチドGGGGCC(G4C2)リピート伸長が起こり,DNAおよびRNAでG4構造とヘアピン構造が混在した状態が形成される6, 7).この核酸構造異常に起因した病態メカニズムがこれまでに四つ提唱されている8).
- ①RNA毒性;G4C2リピートのRNA転写産物が核内にRNA凝集体を形成し,その凝集体に多くのRNA結合タンパク質群を巻き込み,それらを機能不全にすることで神経変性を引き起こす.
- ②repeat-associated non-AUG(RAN)翻訳;リピート伸長RNAにおいて,すべてのリーディングフレームでジペプチドリピートタンパク質が異常翻訳され,神経変性を引き起こす.
- ③C9ORF72タンパク質ハプロ不全;G4DNA構造がRNAポリメラーゼを失速させ,C9ORF72タンパク質産生を抑制する.C9ORF72タンパク質の減少は,グルタミン酸受容体の凝集・機能不全を誘導し神経変性を引き起こす.
- ④内因性DNA損傷;G4DNAが二本鎖切断の形成を促進し,DNA修復経路の機能不全を引き起こす.
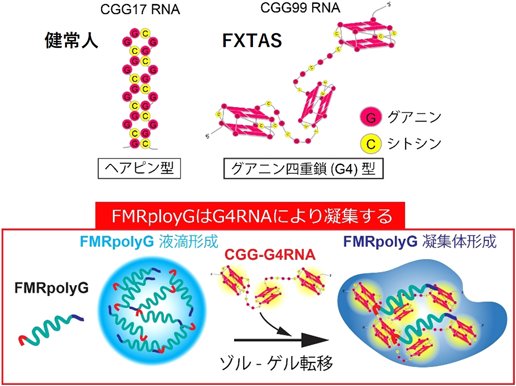
その他の疾患例として,脆弱X随伴振戦/失調症候群(fragile X-associated tremor/ataxia syndrome:FXTAS)があげられる9).FXTASでは,FMR1遺伝子の5′非翻訳領域におけるCGGリピート伸長がみられる.FXTASでは,C9ALS/FTDと同様にRNA毒性が観察され,神経細胞のRNA代謝に異常を来す.またRNA毒性に加えて,RAN翻訳も観察される.伸長したCGGリピートRNAは,RAN翻訳を介して有毒なポリグリシン含有タンパク質「FMRpolyG」を産生する10).
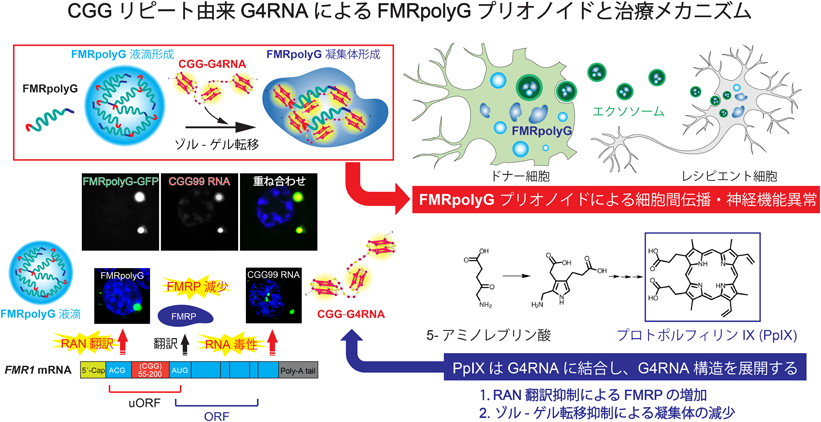
筆者らは,FMRpolyGに含まれるCGGリピート由来のポリグリシン領域にプリオン様の性質があることに着目した.プリオン様領域を持つタンパク質は液-液相分離(liquid-liquid phase separation:LLPS)により液滴を形成することが知られている.予想どおり,FMRpolyG精製タンパク質は液滴を形成した.また,FMRpolyGの液滴をFXTAS発症リピート数である(CGG)99リピートRNAと混合して観察したところ,FMRpolyGは(CGG)99リピートRNAと複合体を形成しゲル状の凝集体となった.RNAの物性解析を行ったところ,健常人のリピート数である(CGG)17リピートRNAがヘアピン型であるのに対し,(CGG)99リピートRNAはG4構造を形成すること,また,(CGG)99リピートRNAはFMRpolyGのポリグリシン領域と直接結合することを見いだした.つまり,FMRpolyGはポリグリシン領域を介して,G4RNAと結合することでゾル-ゲル転移することが明らかになった(図2)11).
次に,FMRpolyGに結合するタンパク質を網羅的に解析した.その結果,FMRpolyGは,神経変性疾患の発症に関与するRNA結合タンパク質群(HNRNPA2/B1, FUS, SFPQ等)と結合することがわかった.また,FMRpolyGは細胞外小胞であるエクソソームに含まれるタンパク質群とも複合体を形成することを見いだした.FXTASモデルマウスの脳由来エクソソームにはFMRpolyGが高発現しており,野生型マウス神経細胞(レシピエント細胞)にFXTASモデルマウス神経細胞(ドナー細胞)由来エクソソームを処置することによって,野生型マウス神経細胞にもFMRpolyGの発現が確認され,神経機能異常がみられた.つまり,FMRpolyGはエクソソームを介して細胞間に伝播し,神経機能異常を引き起こすプリオノイドタンパク質であることを発見した(図3)11).
また,生体内ポルフィリンであるプロトポルフィリンIX(protoporphyrin IX:PpIX)が,G4構造に結合することでプリオノイドタンパク質の凝集を抑制することを発見した.PpIXをFMRpolyGとG4RNAの複合体に処置することで,LLPSを介した凝集体形成が劇的に抑制された.さらに,体内でPpIXへ変換される5-アミノレブリン酸をFXTASモデルマウスに経口投与することでRAN翻訳を抑制し,神経伝達機能,認知機能,運動機能の低下を有意に改善することができた(図3)11).
近年,アルツハイマー病やパーキンソン病等の神経変性疾患の発症にプリオノイド機構が関与することが注目されているが,その細胞内メカニズムは未解明である.このプリオノイドの引き金がG4構造の凝集であると考えられる.現在,タウやαシヌクレインの凝集とG4構造の関与を解析中である.また,FXTASと同様の神経症状を呈するグアニンリッチ・リピートに由来する疾患がロングリード・シーケンス技術により多数発見されている.5-アミノレブリン酸は,安全性の高い既承認医薬品である.したがって,本研究により発見されたプリオノイド機構を基盤とした神経変性疾患全般に対する治療が期待される.
これまで,脳内におけるG4構造の発現および局在に関する情報は皆無であった.筆者らは,脳におけるG4構造の局在を明らかにするため,G4構造認識抗体を利用したマウス脳スライス免疫組織化学解析を行った12).結果として,G4構造は主に嗅球,海馬錐体層,歯状回の顆粒細胞層の神経細胞核内,および小脳プルキンエ細胞核内に多く観察された.G4構造は,海馬CA1領域のMAP2陽性錐体神経細胞の細胞体および樹状突起にも発現がみられたが,GFAP陽性アストロサイトでは弱染色性であった.マウスの神経発生は,胚および周産期の段階だけでなく,成体脳内の2領域(側脳室下帯と海馬歯状回顆粒下帯)でも生涯を通じてみられる.神経発達段階におけるG4構造の変化について検討するために,神経前駆細胞マーカーであるDoublecortin(DCX)陽性細胞と成熟神経細胞マーカーであるCalbindin陽性細胞におけるG4構造とDAPI陽性ヘテロクロマチンの共局在を検討した.G4構造とヘテロクロマチンの共局在シグナルは,DCX陽性神経前駆細胞と比較しCalbindin陽性成熟神経細胞で有意に増加した.さらに,成熟神経細胞での詳細なG4構造局在を検討するために,海馬CA1領域の錐体神経細胞で免疫電子顕微鏡観察を行った.G4構造は核質全体に散在してみられたが,主にヘテロクロマチンで観察された.特に,G4構造は核小体周囲にあるnucleolus-associated chromosomal domains(NADs)に多く観察された12).G4構造は細胞質でも検出されたが,ミトコンドリアなどの特定の細胞小器官では観察されなかった.本研究において,我々はG4構造の脳内局在を解析し,以下のことを明らかにした.1)G4構造は神経細胞に多く形成されるが,グリア細胞にはほとんど形成されない.2)G4構造は神経細胞の樹状突起やポストシナプスにも形成される.3)G4構造は主に核内のヘテロクロマチンに形成される.興味深いことに,G4構造は神経細胞の発達依存的にヘテロクロマチンに形成される.この知見は,G4構造が生体内で時空間的に変動する高次構造体であることを示している.
4. G4構造を標的としたATR-X症候群治療薬の開発
これまで多種多様なG4構造結合リガンドが同定されており,がんをはじめとしたさまざまな疾患に対して治療薬となる可能性が報告されている.前述したC9ALS/FTDのG4C2リピートRNAを標的とするG4結合性小分子リガンドやアンチセンスオリゴヌクレオチドはRNA毒性を抑制するとともにRAN翻訳を阻害することによって,C9ALS/FTDの神経症状を改善することが報告されている13).我々も,異なる観点からG4構造作用薬による脳機能の改善を試みている.これまでに我々は,G4結合タンパク質の一つであるATRXをコードするAtrx遺伝子の変異マウス(Atrxマウス)では認知機能障害がみられることを報告した.さらに,ポルフィリン骨格がG4構造結合能を有する点に着目し,生体内ポルフィリンであるPpIXとヘミンについて検討した.PpIXとヘミンは細胞内で5-アミノレブリン酸から産生される.5-アミノレブリン酸をAtrxマウスに経口投与したところ,認知機能障害が有意に改善した14).ヒトにおいて,ATRX遺伝子の変異はX連鎖αサラセミア・精神遅滞症候群(ATR-X症候群)の原因となる.臨床医との共同研究によりATR-X症候群患者では5-アミノレブリン酸の服用により言語能力が劇的に改善することを症例報告した(医師主導治験実施中)15).この結果は,G4構造が脳機能においてきわめて重要な役割を担うことを裏づけているのと同時に,基礎研究のアイデアがヒト疾患の治療につながった成果である.また,生化学・薬理学だけでなく,臨床医学や核酸化学も取り入れ,分野の枠を超えた融合研究により達成された成果である.
本稿では,ゲノムDNA・RNA高次構造の一つであるG4構造と神経疾患との関与について述べた.一方で,G4構造の神経細胞における「生理的役割」は不明である.神経細胞は,通常の体細胞とは異なるレベルの情報システムを形成している.この情報システムは,神経細胞どうしの階層的なネットワークや回路を基盤とし,分子の階層であるゲノム高次構造とも密接な相互依存関係にある.体細胞では,個々の細胞にランダムに蓄積したさまざまなゲノム高次構造の変化が集合し,その記憶が個性(臓器の機能)として表現される.さらに神経細胞においては,細胞レベルのゲノム構造の変化に起因する個性が神経回路の「高い自立性」と「興奮伝達の共通原理」によりネットワークとして共有され,「統合」される.つまり,「経験」による神経細胞の「個性」がネットワーク全体で「記憶・統合」される.現在,筆者らはG4構造と「脳の個性」の関与について解析中であり,ゲノムDNA・RNA高次構造が個性を生み出す可能性を模索している.