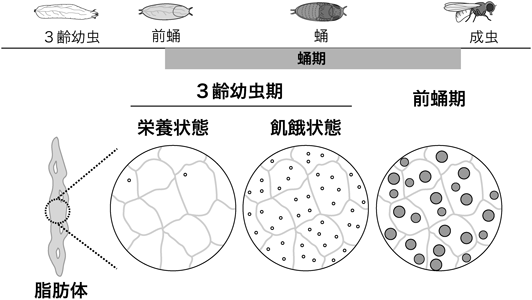
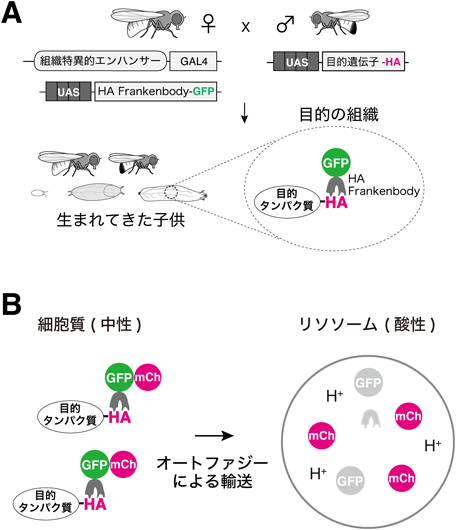
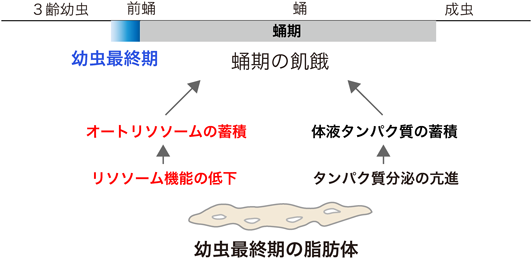
脂肪体における“変態ホルモン誘導性オートファジー”The molting hormone-induced autophagy in Drosophila fat body
東京工業大学科学技術創成研究院細胞制御工学研究センターCell Biology Center, Institute of Innovative Research, Tokyo Institute of Technology ◇ 〒226–8503 横浜市緑区長津田町4259 S2–11 ◇ S2–11 4259 Nagatsutacho Midori-ku, Yokohama 226–8503, Japan