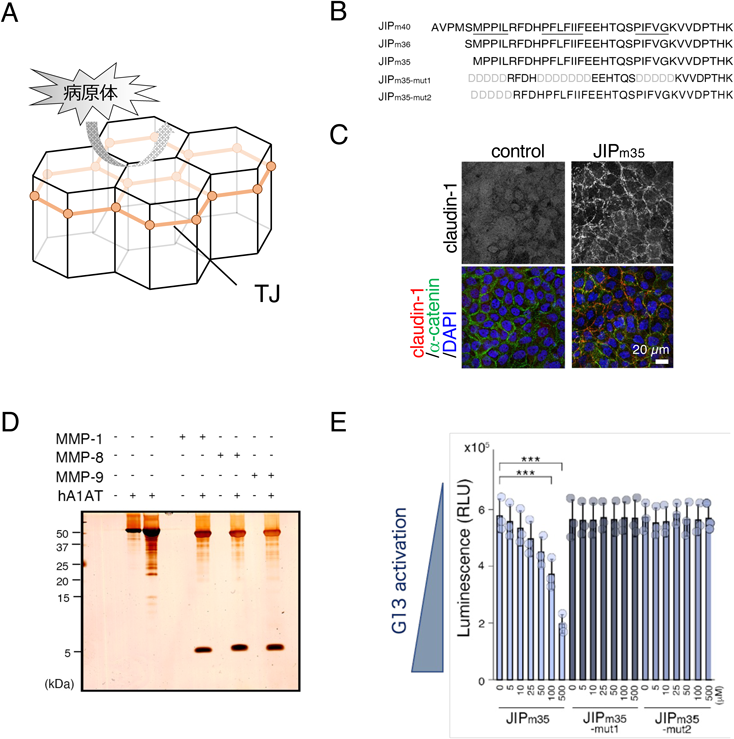
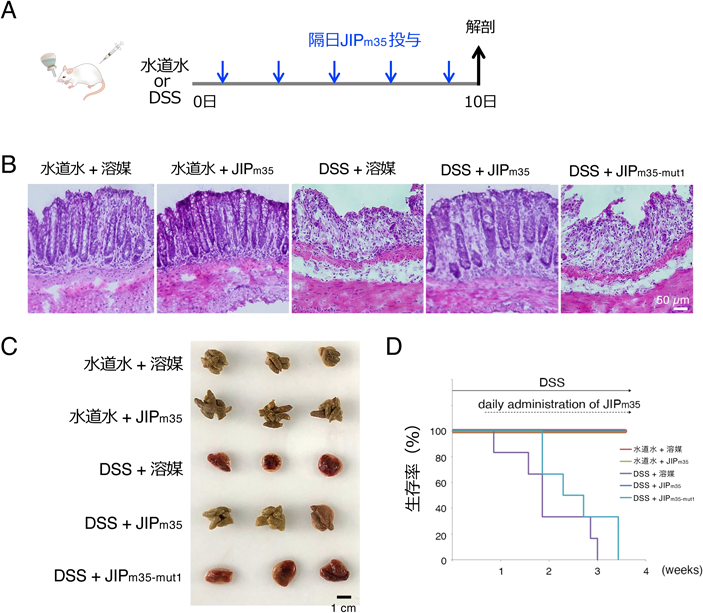
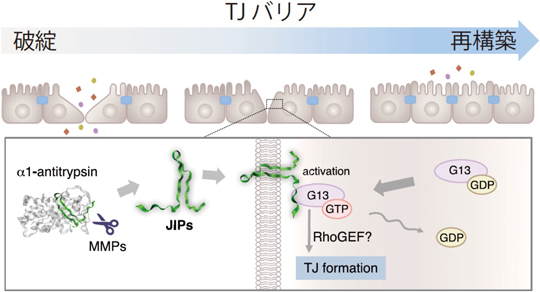
タイトジャンクションの形成を誘導する新規生理活性ペプチドJIPの発見Discovery of physiologically active peptides JIP that induce tight junction formation
京都大学iPS細胞研究所Center for iPS Cell Research and Application, Kyoto University ◇ 〒606–8507 京都市左京区聖護院川原町53 ◇ 53 Kawahara-cho, Shogoin, Sakyo-ku, Kyoto 606–8507, Japan