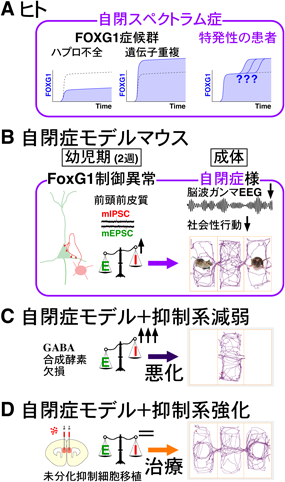
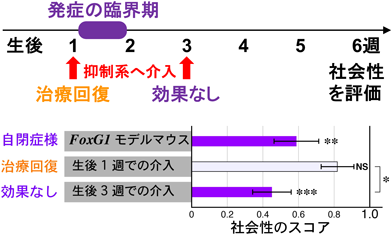
自閉スペクトラム発症の臨界期における抑制回路発達機構の解明An early juvenile critical period for autism-associated inhibitory circuits
群馬大学大学院医学系研究科遺伝発達行動学講座Gunma University Graduate School of Medicine, Department of Developmental Genetics and Behavioral Neuroscience ◇ 〒371–8511 群馬県前橋市昭和町3丁目39番22号 臨床研究B棟7階 ◇ 3–39–22 Showa-machi, Maebashi, Gunma 371–8511, Japan