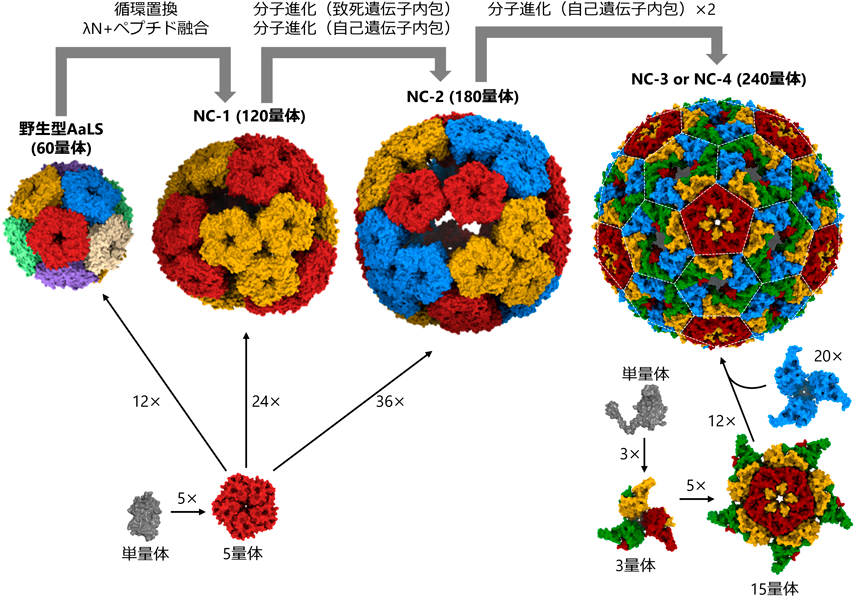
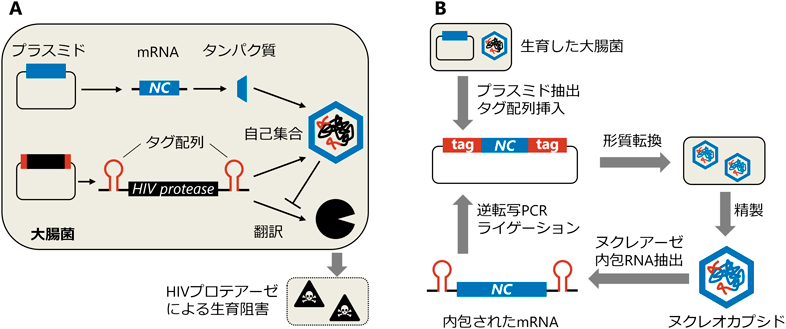
細菌タンパク質をウイルス模倣ヌクレオカプシドに分子進化させるEvolution of a viral-mimicking nucleocapsid from a bacterial protein
東京工業大学地球生命研究所Earth-Life Science Institute, Tokyo Institute of Technology ◇ 〒152–8550 東京都目黒区大岡山2–12–1–I7E-319 ◇ 2–12–1–I7E-319 Ookayama, Meguro-ku, Tokyo 152–8550, Japan