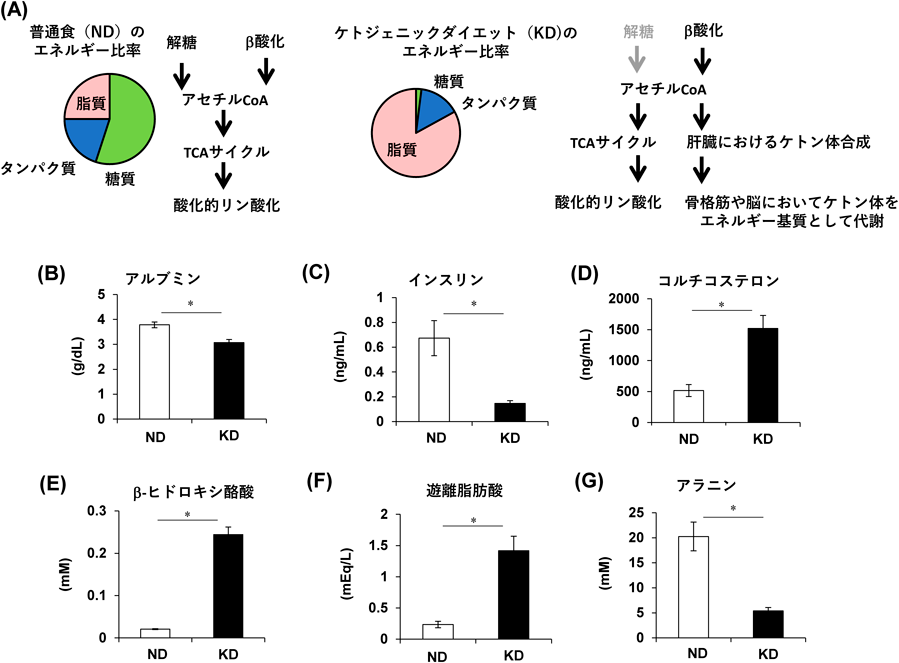
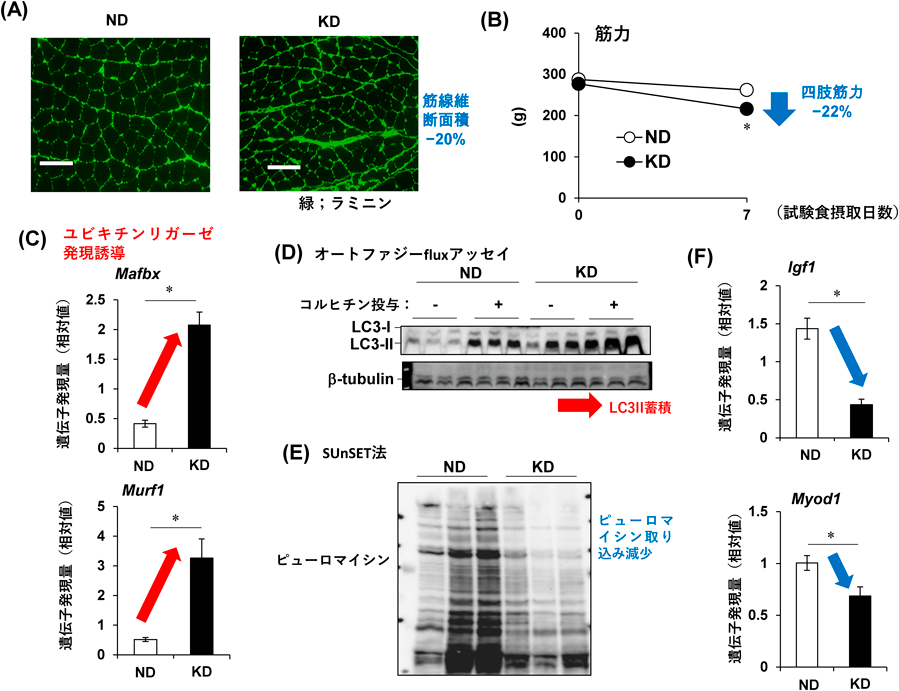
ケトジェニックダイエット摂取に対する骨格筋の応答Response of skeletal muscle under ketogenic diet
徳島大学大学院医歯薬学研究部生体栄養学分野Department of Nutritional Physiology, Institute of Biomedical Sciences, Tokushima University Graduate School ◇ 〒770–8503 徳島市蔵本町3–18–15 ◇ 3–18–15 Kuramotocho, Tokushima 770–8503, Japan