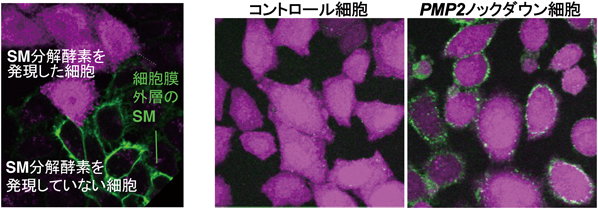
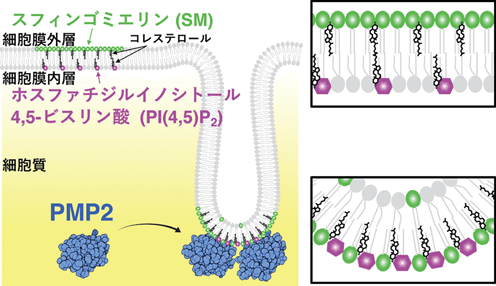
可視化することでわかってきた細胞膜のスフィンゴミエリンの動態と分布Visualization of sphingomyelin reveals the dynamics and distribution of the lipid in the plasma membrane
理化学研究所開拓研究本部RIKEN Cluster for Pioneering Research ◇ 〒351–0198 埼玉県和光市広沢2–1 ◇ 2–1 Hirosawa, Wako, Saitama 351–0198, Japan