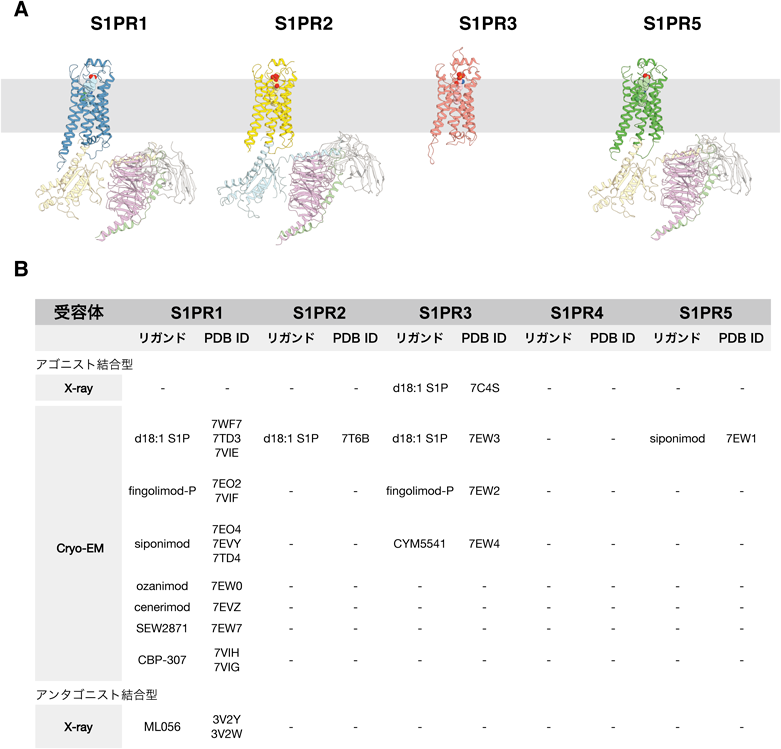
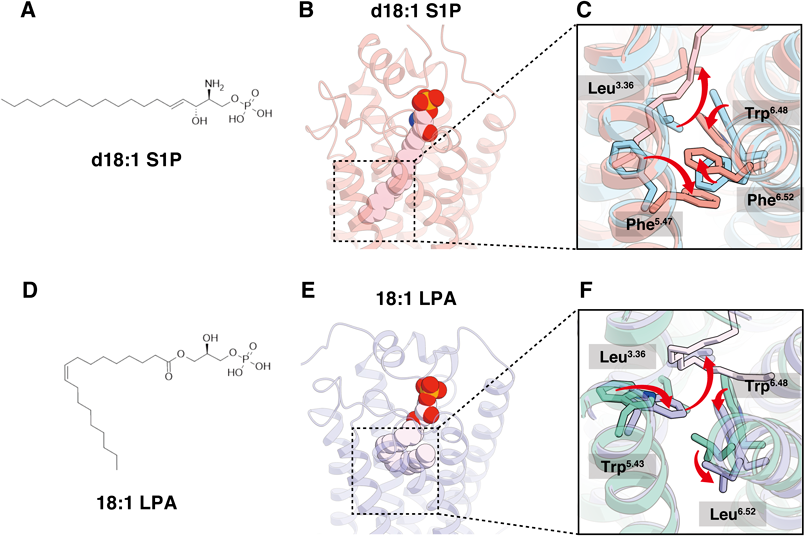
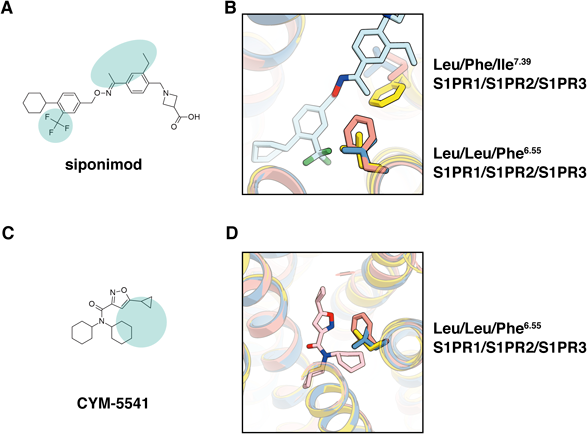
スフィンゴシン1-リン酸受容体の構造解析から明らかとなりつつある受容体活性化機構とシグナル伝達Structural insights into activation and signal transduction of sphingosine-1-phosphate receptors
1 京都大学大学院医学研究科形態形成機構学Department of Anatomy and Developmental Biology, Graduate School of Medicine, Kyoto University ◇ 〒606–8501 京都府京都市左京区吉田近衛町京都大学大学院医学研究科 ◇ Bldg. C, Level 3, Graduate School of Medicine, Kyoto University, Yoshida Konoe-cho, Sakyo-ku, Kyoto 606–8501, Japan
2 京都大学大学院医学研究科分子細胞情報学Department of Cell Biology, Graduate School of Medicine, Kyoto University ◇ 〒606–8501 京都府京都市左京区吉田近衛町京都大学大学院医学研究科 ◇ Bldg. A, Level 3, Graduate School of Medicine, Kyoto University, Yoshida Konoe-cho, Sakyo-ku, Kyoto 606–8501, Japan