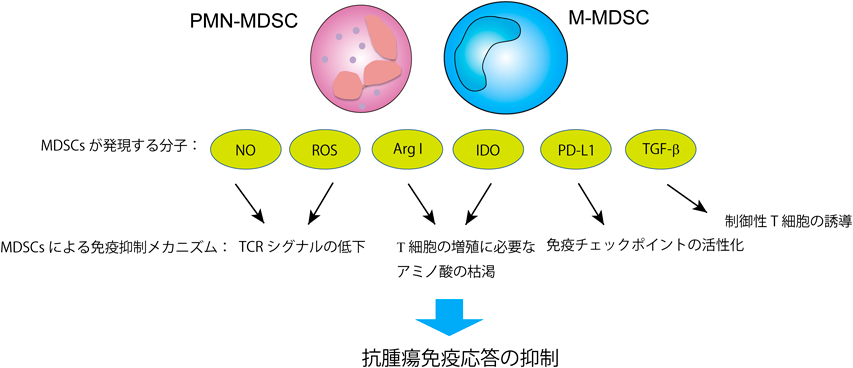
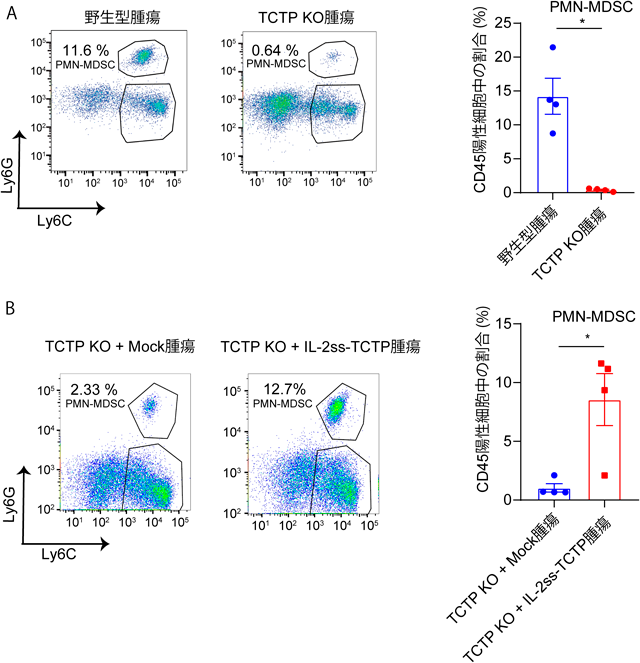
死細胞由来分子群による腫瘍免疫微小環境の調節機構Orchestration of tumor immune microenvironment by dead-cell derived molecules
1 Herbert Irving Cancer Center, Columbia UniversityHerbert Irving Cancer Center, Columbia University ◇ 1130 St. Nicholas Avenue 2nd Floor, Room 201 New York, NY 10032 United States ◇ 1130 St. Nicholas Avenue 2nd Floor, Room 201 New York, NY 10032 United States
2 東京大学先端科学技術研究センターResearch Center for Advanced Science and Technology, The University of Tokyo ◇ 〒153–8904 東京都目黒区駒場4–6–1 ◇ 4–6–1 Komaba, Meguro-ku, Tokyo 153–8904, Japan