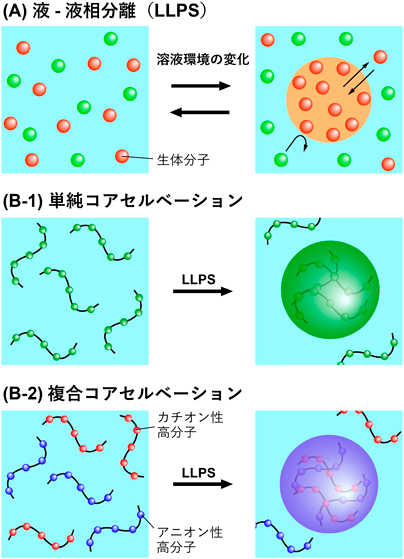
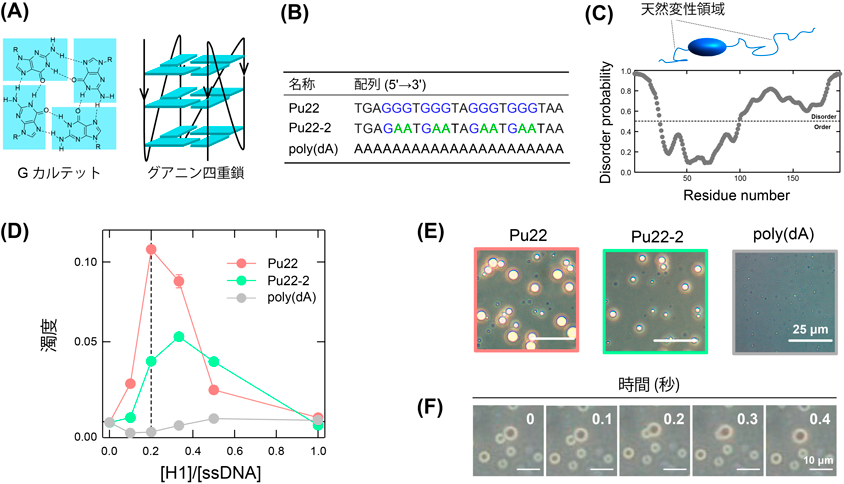
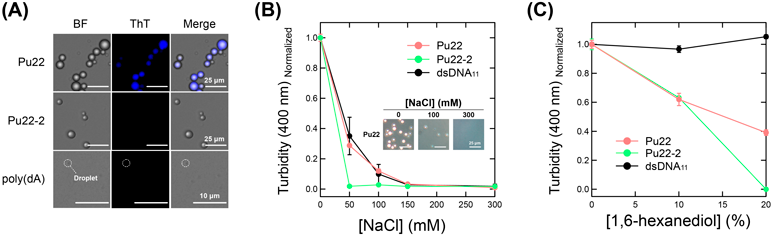
グアニン四重鎖構造が誘起するヒストン/DNA液–液相分離Liquid–liquid phase separation of histone/DNA induced by G-quadruplex structure
1 産業技術総合研究所健康医工学研究部門Health and Medical Research Institute, National Institute of Advanced Industrial Science & Technology (AIST) ◇ 〒305–8566 茨城県つくば市東1–1–1 中央第六 ◇ Central 6, Higashi 1–1–1, Tsukuba, Ibaraki 305–8566, Japan
2 筑波大学大学院数理物質科学研究科Faculty of Pure and Applied Sciences, University of Tsukuba ◇ 〒305–8573 茨城県つくば市天王台1–1–1 ◇ Tennodai 1–1–1, Tsukuba, Ibaraki 305–8573, Japan