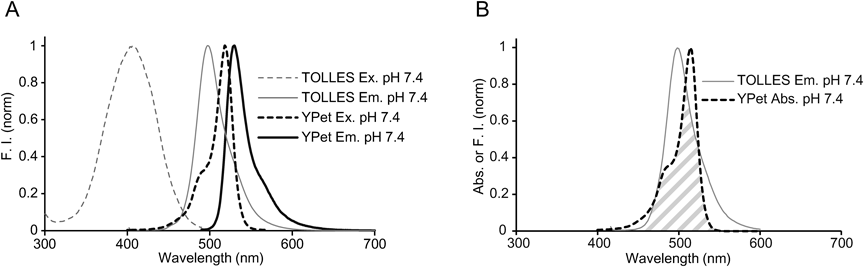
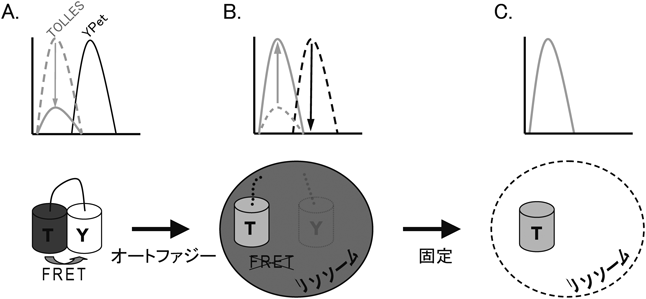
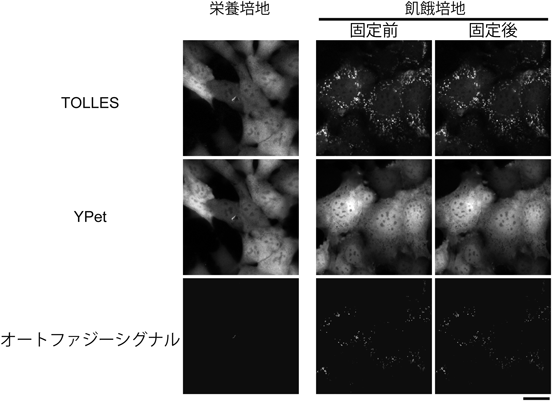
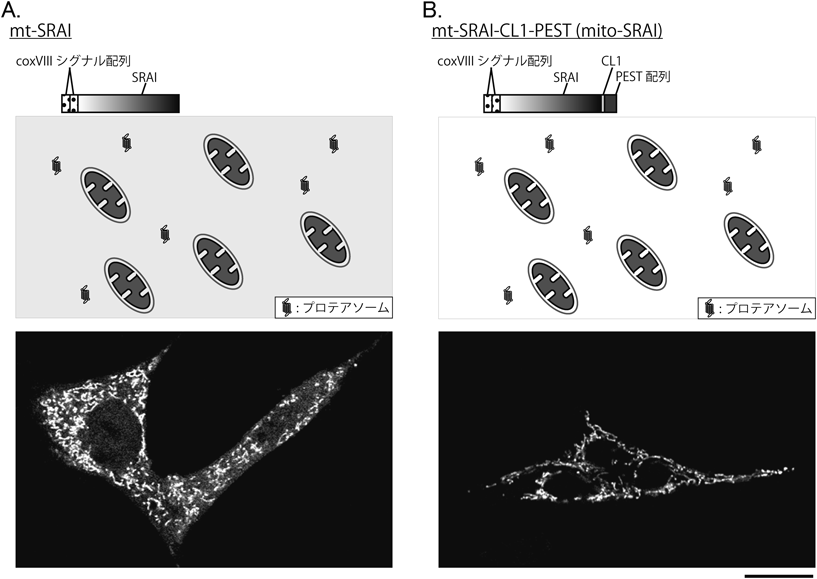
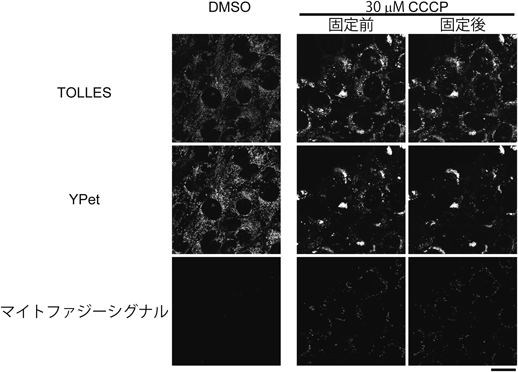
シグナル残存型マイトファジープローブ—mito-SRAI—Mitophagy probe—mito-SRAI—
理化学研究所脳神経科学研究センター細胞機能探索技術研究チームLaboratory for Cell Function Dynamics;RIKEN Center for Brain Science (CBS) ◇ 〒351–0198 埼玉県和光市広沢2–1 ◇ RIKEN Center for Brain Science, 2–1 Hirosawa Wako, Saitama 351–0198, Japan