通常の成人の脳は,約1000億個に及ぶ神経細胞からなるといわれる.脳の機能的ネットワーク構築の鍵は,解剖学的に素子的な単位であるシナプスの形成と機能維持にある.神経ネットワーク形成は複雑だが,発達過程で非常に精密な配線がなされる.この配線に必須な要素は,一つは脳発達期にそれぞれの神経細胞が決められたパートナーを探し当てて特異的回路を形成する「特異性」であり,もう一つは神経活動の強弱によって情報伝達効率を調節する「可塑性」の二つに集約される.これらは神経系における高度な遺伝的プログラムと特異的な発現制御によって支配されると考えられるが,2000年前後のヒトゲノムプロジェクトの結果から,タンパク質をコードする我々ヒトの遺伝子数が3万個にも満たないレベルであることがわかり,当初10万個以上と考えられていた予想を大幅に下回った.このような限られた遺伝子数でどのように神経ネットワークがプログラムされているのか,すなわち神経細胞の新生から細胞移動,軸索ガイダンス,シナプス形成に至るまでの発達過程のさまざまなステップがいかにして正確に遺伝的にプログラムされているのか,また,生涯イベントである学習や経験がどのように遺伝的プログラムを変革させ,神経ネットワークの変化を誘導していくのであろうか? 近年のハイスループット解析やシングルセル技術の進歩により,神経細胞の複雑な遺伝プログラムが詳細にプロファイルされ,年々確実に理解が深まりつつあるが,いまだに多くのブラックボックスが残されている.
これまで著者は複雑かつ精密な神経回路構築に重要な神経細胞の多様性,シナプス結合の特異性や神経可塑性を築くトランスクリプトームレベルの分子基盤として本特集のテーマである「選択的スプライシング機能」に注目してきた.神経系では複数のスプライシング調節因子の発現や活性,相互作用によりさまざまな様式で時空間的にスプライシングが制御されており,生命情報の多様性獲得に寄与している.本稿ではこの時空間的な選択的スプライシングの仕組みとして,神経活動依存的制御,神経細胞タイプ特異的制御,および3′末端側RNAプロセシング制御の三つのスプライシング調節について,特にこれを制御するキーファクターとなるスプライシング調節因子の最近の知見を中心に紹介する.また,本稿の最後ではこのようなスプライシング制御を標的とした新たな創薬アプローチについても考えていきたい.
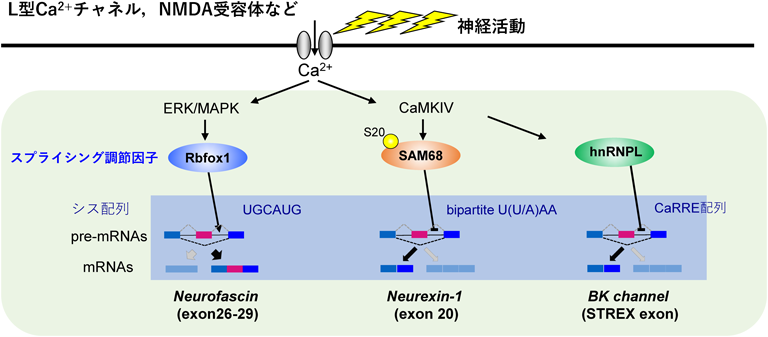
神経細胞では脳の活動変化に応じてダイナミックにスプライシングパターンが変化する.NMDA受容体やL型Ca2+チャネルからのCa2+流入によって,シナプスタンパク質をコードする複数のpre-mRNAの選択的スプライシング変化が起こることが発見され1, 2),これが成熟脳でのシナプス機能に重要な役割を果たしていることが古くより示唆されてきた3).この神経活動に依存した選択的スプライシングの分子メカニズムや機能が近年ようやく具体的に理解されつつある.そこで,著者らの研究を中心としてこれまで報告された三つの制御機構について述べたい.
1)CaRREおよびUAGG配列に依存的な選択的スプライシング制御と適応的な神経可塑性の調節
選択的スプライシングを受けるエクソン部位と近傍のイントロン内にはスプライシングに関わるリプレッサーやエンハンサー配列が複数存在するが,これまで神経活動依存的に働くものとして,Ca2+-カルモジュリンキナーゼIV(CaMKIV)経路の制御下で作用するシスRNA配列が発見されてきた.Blackらはこのようなエレメントとして大コンダクタンスカルシウム活性化カリウムチャネル(BKチャネル)においてCa2+感受性ドメインをコードするstress-axis regulated(STREX)エクソンの近傍のイントロン部位などから2種類のCaRRE配列(CaMKIV-responsive RNA element)を同定した4).またこれとは別に,GrabowskiらはNMDA型グルタミン酸受容体GluN1(NR1)においてシナプス膜移行エレメントをコードするCIエクソン部位からCa2+依存的な選択的スプライシングのサイレンサー配列としてUAGG配列を同定した5).これらの配列をスプライシングレポーターへ導入するとCaMKIV依存的なスプライシング変化が誘導されること,またCa2+依存的にスプライシング変化が引き起こされることが知られるGABA受容体,synGAP, SNAP25などをコードするいくつかのpre-mRNAのスプライシング部位にもこの配列がみられたことから,CaRREおよびUAGG配列はCaMKIV依存的スプライシングにおけるコンセンサス配列であることが強く示唆された3).
CaMKIVがどのようにCaRRE配列やUAGG配列に作用してスプライシングを制御するのだろうか? これらのシス配列に結合するトランス側のRNA結合タンパク質群の解析が行われ,CaRRE配列に結合し脱分極に依存したSTREXエクソンのスキッピングに関わる分子としてhnRNPLが同定されている6, 7)(図1).
このような神経活動によるスプライシングアイソフォーム変化が神経機能にどのような影響を及ぼすのだろうか? これまでの発見をまとめると,その多くが神経細胞の適応的変化として起こる傾向が強い.BKチャネルはSTREXエクソンの挿入によってCa2+感受性が亢進されることから,脱分極後に起こる細胞内へのK+の再取り込みによる過分極過程に重要な役割を果たす2).またNR1のCIエクソンの挿入は培養大脳皮質細胞を用いた実験においてシナプス膜表面へのNMDA受容体の移行を促進することが示されている8).これらのことから,BKチャネルとNR1における神経活動依存的なスプライシングアイソフォームの変化は脳の適応的変化として起こるシナプス活動の最適化(ホメオスタティックな可塑的変化)に寄与すると考えられた1, 3, 9).
2)SAM68によるシナプスオーガナイザーの選択的スプライシング制御とシナプス伝達調節
しかしながら,上記のCaRREやUAGG配列はCa2+-CaMKIV経路に依存的に選択的スプライシングを受けるpre-mRNAの一部にしかみられない.このことから,CaRREやUAGG配列依存的な制御とは独立した他の未知のメカニズムが複数存在することが推定された.その後,著者らは上記のメカニズムとは異なる新しいCaMKIV依存的制御として,シナプス誘導因子であるNeurexin遺伝子(Nrxn)の選択的スプライシングのメカニズムを同定した.著者らは,このNrxnのexon20が高カリウム処理による脱分極刺激でスキップされることを明らかにし,その選択的スプライシングを制御する分子としてSAM68を同定した10)(図1).SAM68は神経活動によって細胞内局在および発現量は変化しておらず,その代わり神経活動依存下でCaMKIVによりリン酸化されていた.このことから,神経活動によってCaMKを介してSAM68が活性化され選択的スプライシングの変化を誘導していることが示された.
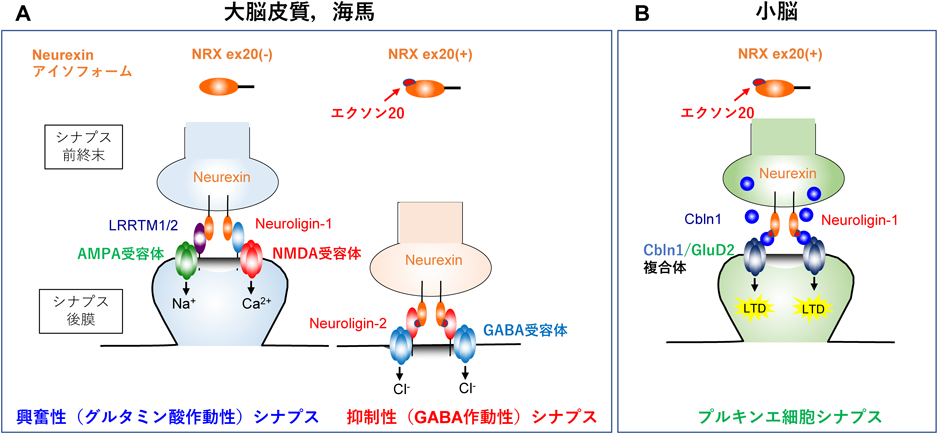
Neurexinタンパク質(NRX)はシナプス前終末に局在し,シナプス後膜上の受容体との相互作用を介してシナプス形成を誘導する.受容体にはNeuroliginファミリー,LRRTMファミリー,Cbln1–GluD2複合体などこれまで多くの受容体が同定されており,どの受容体に強く結合するかの選択性,親和性は90 bpのexon20の挿入の有無で決定される11, 12).重要なことに,このexon20が挿入されるかスキップされるかは神経細胞タイプで厳密に決まっている(詳細は3-1)項で後述).興奮性ニューロンではexon20がスキップされたNRX exon20(−),抑制性ニューロンではこれが挿入されたNRX exon20(+)となっており,興奮性と抑制性のシナプス特性を大きく分ける非常に重要な仕組みとなっている(図2A).
神経活動依存的なNrxnのスプライシング変化は,そのような受容体結合をダイナミックにスイッチさせ,シナプスの形態的および機能的変化を引き起こすと考えられる.実際に,抑制性ニューロンと同じくNRX exon20(+)を発現する小脳顆粒細胞では,脱分極刺激によってNRXに依存したシナプス形成に変化を引き起こすことを明らかにした10).小脳において,NRXはCbln1とGluD2と呼ばれる受容体との相互作用を介してプルキンエ細胞とのシナプス形成を果たす13–15)(図2B).また,Cbln1とGluD2は成熟した平行線維-プルキンエ細胞間シナプスに起こる長期抑圧(LTD)と呼ばれるシナプスの可塑的変化に必須な分子であり,顆粒細胞での神経活動依存的なNrxnのスプライシングアイソフォーム変化により引き起こされるGluD2から他の受容体へのスイッチングは小脳皮質の機能的シナプス数を負に制御し,やはり上記のBKチャネルなどと同様にホメオスタティックな可塑性の制御に寄与している可能性が考えられる16).
3)Rbfox1による軸索構成分子の選択的スプライシング制御と神経発火の調節
さらに近年,著者らはSAM68の次に中枢神経系で活動依存的に働く新規のスプライシング調節因子としてRbfox1を同定した17).Rbfox1によるスプライシング変化もCa2+流入によって誘導されるが,これまで発見された上記のスプライシング制御はすべてCaMK経路を介していたのに対し,Rbfox1の場合はERK-MAPK経路を介しており,活動依存的スプライシング制御の複雑さや多様性が示された(図1).
興味深いことに,Rbfox1の主な標的スプライシング基質は,軸索構成分子をコードするpre-mRNA群にエンリッチする傾向が強い18).神経細胞は樹状突起上の多数のシナプスからの入力を受けるのに対し,出力は1本の軸索のみである.その根元に位置する軸索起始部(axon initial segment:AIS)は活動電位を発生させる唯一の情報出力部位であり,軸索ではここに多くの機能的タンパク質が密に集積する.実際にRbfox1のノックアウトマウスでは神経発火に異常を持つことから19),Rbfox1のスプライシング活動がAIS機能に強く関わることが推測されてきた.
AISは長年にわたり固定的インフラ構造と思われてきたが,近年では経験や加齢,病態によって可塑的に変化する(AIS可塑性)ことが知られ20, 21),最近著者らはAISの可塑的変化の過程で,Rbfox1が主要なAIS構成分子である接着因子Neurofascinの選択的スプライシングを行っていることを発見した17).上記のように,Rbfox1は複数のAIS構成分子の選択的スプライシングに関わっていることから,NeurofascinだけでなくAIS可塑性の過程で多くのスプライシング変化をもたらしていると予想された16).実にごく最近,著者らはRbfox1がAIS可塑性において特定AIS構成分子の微小エクソンのスプライシング変化を強く引き起こすことを発見しており(Suzukiら未発表データ,投稿準備中),この詳細な仕組みについて現在解析を進めている.AIS可塑性もまた適応的な変化と考えられており,AISが環境に応じて柔軟に変化することで脳機能を積極的に調節すると予想される.しかしながら,脳の適応的な回路再編についてはまだ多くのことが知られておらず,このような分子基盤の解明が適応脳の理解に大きな貢献をもたらすかもしれない.
脳組織の神経ネットワークは多くの神経細胞タイプによって構成される.神経細胞はそのサブクラスごとにユニークな形態的・機能的特性を呈するが,神経細胞タイプに特異的なスプライシングによる生命情報の多様化は,個々のタイプの神経機能をさらに複雑化させる.神経細胞タイプに特異的なスプライシングプログラムは,複数のスプライシング調節因子がそれぞれ特徴的な時空間的発現パターンをとり,また一部では相互作用しあうことにより創出される.
1)シナプスオーガナイザーの細胞タイプ特異的スプライシング制御による興奮性/抑制性シナプス特性の区分化
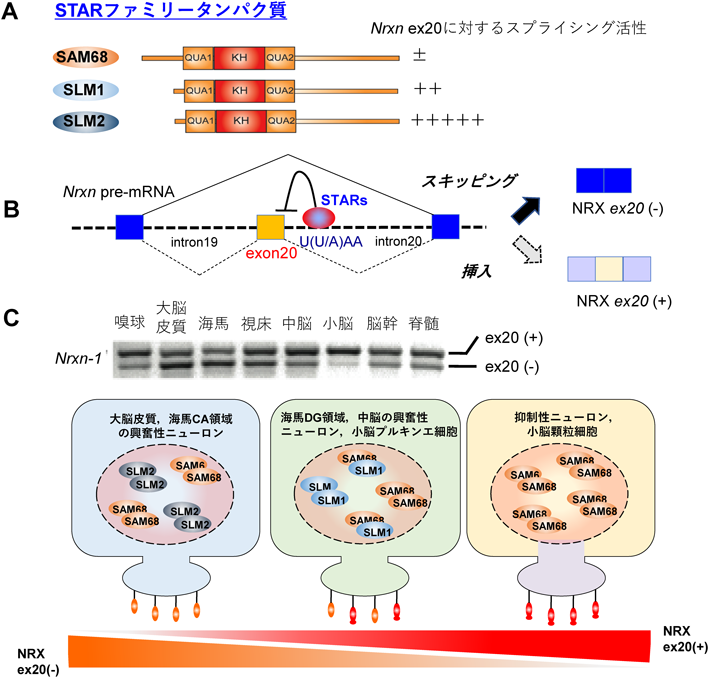
これまで著者らは,脳組織で特徴的発現パターンを示す興味深いスプライシング調節因子としてSLM1とSLM2(Sam-like molecule1, 2)を同定してきた22).SLM1とSLM2は,SAM68と同じKH型RNA結合ドメインを持つSTARファミリータンパク質に属する23)(図3A).しかし,非常に高いアミノ酸配列の相同性にもかかわらず,標的とするスプライシング基質や活性には大きな違いがあることがわかってきた22, 24, 25).NeurexinはSAM68, SLM1, SLM2に共通したスプライシング基質であり,いずれもexon20近傍のイントロン領域にあるAUリッチ領域に結合しexon20のスキッピングを誘導する10)(図3B).しかし前節で述べたように,SAM68は神経活動亢進時以外の定常状態ではほとんどNrxnに対するスプライシング活性はなく,通常はSLM2がドミナントに支配していることがわかった26, 27)(図3C).しかも,SLM2はNeurexin以外にはスプライシング基質をほとんど持たないという非常にユニークな特性を持っていた24).前節で,興奮性ニューロンではexon20のスキップされたNRX exon20(−),抑制性ニューロンでは挿入されたNRX exon20(+)がドミナントに発現しており,興奮性と抑制性のシナプス特性を分ける仕組みであることを述べたが(図2A),このニューロンタイプにおけるNRXのスプライシングパターンの違いは,SLM2の脳組織における特異的発現パターンによってほぼ築かれる.実に,SLM2は海馬や大脳皮質では興奮性ニューロンで選択的に発現し,抑制性ニューロンタイプではほとんど発現していない28)(図3C).このSLM2の特異的発現パターンと強いスプライシング活性が,Nrxn exon20のスキッピングを介して興奮性と抑制性のシナプス特性を区分する仕組みの分子基盤になっていたのである.
2)抑制性ニューロンサブタイプ間におけるスプライシングプログラムの多様性
抑制性ニューロンタイプはニューロン全体の20%程度であるが,興奮性ニューロンタイプよりも形態,機能ともはるかに多様性に富んでいる.SLM2は抑制性ニューロンタイプではほとんど発現していないものの,発生後期に誕生するごく一部の抑制性ニューロンのサブタイプでは強く発現していることがわかり,最近著者らはこの細胞集団によって「興奮性によく似たシナプス特性を持つ抑制性シナプス」が作られていることを発見した29).このように,SLM2の非常に複雑な発現パターンによって,抑制性ニューロンタイプ間でもさらなる多様化が起こっている.また,前述のRbfox1においても,他のニューロン群に比べ発生前期に誕生する抑制性ニューロンサブタイプで有意に高い発現をしており,このようなスプライシング調節因子群の特徴的発現形式が,抑制性ニューロンサブタイプ間のシナプス特性の違いを築いていることが明らかにされてきた30).このように,細胞タイプ特異的なスプライシング選択は,神経細胞タイプの特性をさらに多様化させ個々の細胞集団の形態的・機能的アイデンティティの構成に非常に重要な働きをしており,それらの神経細胞にユニークなシナプス特性など,微細な構造や機能のレベルの多様性に寄与していることが解明されつつある.実際に,神経細胞タイプ間でのトランスクリプトーム比較から,エクソンレベルでの明確な違いが示され31, 32),シングルセル技術のさらなる高解像度化に伴い,今後スプライシングプログラムに基づいた神経細胞サブクラスごとの詳細な分類も可能になるだろう.
1)時空間的なALE選択プログラム
上記でふれたNrxnのexon20などはカセット型エクソンであり,タンパク質の一部の機能ドメインに変化をもたらすケースである.しかしながら,mRNAの多様性はこのような選択的スプライシングだけでなく,本来除去されるはずのイントロン配列の一部がエクソンとして挿入され,その配列の3′末端側がそのままポリA化されることによって生み出されるケースもある.つまり完全長のmRNAができずにスプライシングが途中終結し3′末端側が短縮したアイソフォームができる.
スプライシング異常によって出現することもあるが,実に多くの遺伝子に途中終結したmRNAアイソフォームがある割合で生理的に存在し,単一遺伝子から3′末端側の長さの異なる複数の機能的なmRNAアイソフォームが生じている.このような3′末端側が短縮し安定して生み出される遺伝子産物を,本稿ではALE(alternative last exon)アイソフォームと呼ぶことにする.mRNAが3′末端側で極端に短くなった場合,タンパク質レベルではC末端側の欠けたアイソフォームができる.C末端部の欠失は機能喪失を招くことがあるが,遺伝子によっては,短いALEアイソフォームが特殊な機能を持つものもあり,時にはドミナントネガティブな性質を持つアイソフォームを導くこともある(後述).重要なことに,このようなALE選択と機能は組織臓器によって異なる.このことから,ALE選択は各組織領域において明確な生物学的意義を持ち,それぞれで異なるユニークな制御によって時空間的にプログラムされていると考えられる33).
2)U1 snRNPによる異常ALE制御の防止機能
また,がんのような病態時に異常なALEアイソフォーム出現が起こるという報告があり34),これは生理的ALE制御の破綻が病態と密接な関係を持つことを意味している.しかし,異常なイントロン切断とポリA化については,生体内にこれを防ぐ普遍的な仕組みが備わっている.スプライソソームであるU1 snRNPはそのファクターである.U1 snRNPは,スプライシングのイントロン除去における最初の段階である5′スプライス部位へのスプライソソームの集積に関わる普遍的機能が知られるが,5′スプライス部位だけでなくイントロンのあらゆる箇所に結合してイントロンの異常な中途切断とポリA化を防ぎ,トランスクリプトームレベルでの品質管理を行っている35).
3)SAM68の組織特異的なALE選択によるシナプス形成と可塑性の制御
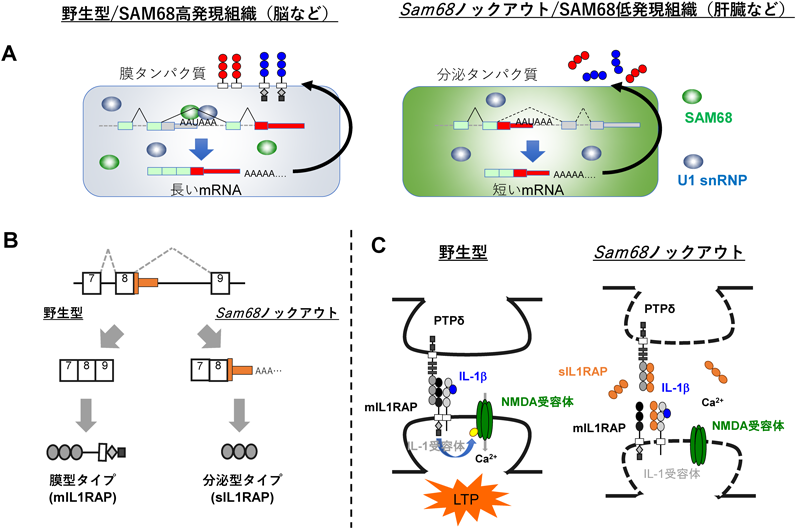
では,ALE選択の生理的意義は何か? 組織領域でどのようなALE選択が行われているのだろうか? 最近著者らは,組織特異的なALEの空間的プログラムの仕組みを明らかにしてきた.前述のSAM68が神経活動依存的なファクターであることに加え,神経系のALE制御のファクターであることを見いだし,組織特異的なALE制御の新しいメカニズムを解明した25).まず神経系でのSAM68のスプライシング基質を網羅的にスクリーニングしたところ,3′非翻訳領域(3′UTR)をコードするエクソンが多く変動していることが観察された.ALEの大部分のパートはストップコドンの後に続く3′UTRである.詳しく調べていくと,Sam68ノックアウトマウス脳ではALE選択が変化しmRNAの3′末端側が短いアイソフォームが多く出現することがわかった.この異常は膜タンパク質をコードするmRNAによくみられ,この場合短縮化によってC末端の膜貫通ドメインが欠如し,膜タンパク質が分泌型タンパク質に変化しているケースが複数みられた(図4A).この中で興味深いものとして,著者らは膜型シナプス接着因子IL-1 accessory protein(IL1RAP)でのALE異常にフォーカスした.Sam68欠損マウス脳ではIL1RAPの異常なALE選択によってmRNAが短縮し,神経系では本来膜タンパク質であるはずのIL1RAPがC末端部の欠如によって非典型的な分泌型アイソフォームに変わっていた(図4B).この変化は膜型IL1RAPタンパク質の減少を引き起こすのに加えて,出現した分泌型IL1RAPが残りの膜タンパク質と競合し,ドミナントネガティブ効果を持ってシナプス機能が障害されることを明らかにした(図4C).
ところで,SAM68非発現組織においてIL1RAPのALE選択はどのようになっているのであろうか? SAM68の発現は組織特異的であり脳や精巣では強い発現が認められるのに対し,肝臓などではみられない.肝臓におけるIL1RAPのALEアイソフォームについて調べたところ,肝臓ではほとんどが分泌型であり,SAM68非発現組織ではこの分泌型が生理的アイソフォームとして存在していた.このことから,SAM68が臓器特異的なALE制御のファクターとして機能し,各臓器でそれぞれのALEアイソフォームが異なった機能を持って働くことも示唆された(図4A).
著者らの発見と同時期に,SAM68によるALE制御の詳しい分子メカニズムも調べられており,SAM68がイントロン上のポリA付加部位近傍に結合し,上記で述べたスプライソソームU1 snRNPと協調作用によってmRNAの短縮化を防いでいることが報告された36)(図4A).しかしながら,ALE選択の時空間的な調節の詳しいメカニズムはようやく解明され始めたばかりであり,トランスクリプトームの多様性のメカニズム研究の中で,今後多くの進展がみられそうな領域である.
5. おわりに—神経系スプライシング制御を標的とした創薬の可能性
スプライシングを標的とした近年の創薬開発には目覚ましいものがある.特にアンチセンス核酸(ASO)であるスピンラザなどは難病である脊髄性筋萎縮症(SMA)の発症防止に著しい効果をあげた.このような有効性から,スプライシング調節により脳活動を有効的かつ長期的にコントロールし,発達障害・精神疾患の治療につなげていくことなども将来的に可能かもしれない.
脳の恒常的維持は,興奮性と抑制性ニューロンの活動バランス(E/Iバランス)が重要な要素であり,このバランスの乱れは発達障害・精神疾患に共通した病態である.てんかんはもちろんのこと,統合失調症,躁うつ病,自閉症では興奮性優位となり,その原因はシナプス伝達の過剰な亢進もしくは抑制性機能の低下にある.神経・精神疾患や睡眠障害などでE/Iバランスを整えるために用いる現在の手段は,イオンチャネルやモノアミントランスポーター,GPCRなどの拮抗薬や作動薬による神経伝達調節である.しかし,将来的にシナプスを構造から変えるような手段が確立されれば,E/Iバランスの長期的改善が期待できる.そういった点から,本稿であげた中枢神経系の普遍的シナプスオーガナイザーNeurexinのスプライシング調節は非常に興味深い.Neurexinは興奮性シナプスではグルタミン酸受容体,抑制性シナプスではGABA受容体のシナプス集積を適切に制御することによって,興奮性,抑制性シナプスの機能的仕分けを行う(図2A).Neurexinの重要性は遺伝子変異や多型が複数の精神疾患・発達障害と関連することからも明らかである.前述のように,この仕分けはNeurexin遺伝子のわずか1か所の選択的スプライシング部位の制御であり,このexon20の特異的スキッピングの人工調節は,シナプスを構造から変革させ脳の活動バランスを調節する有効手段となりうるかもしれない.
スプライシング阻害による治療の有効性が認められるのはまだASOのみであるが,特異的RNP複合体をトラップしスプライシング調整を阻害するデコイRNAなどの開発も進んでいる37).RNP複合体は通常多くの標的RNA基質を持つが,SLM2はNeurexin以外の基質をほとんど持たないユニークな因子であり24),その特異性は創薬標的としてふさわしい.
現在のところ核酸医薬は非常に高額な医療であり,一般レベルでの浸透にはまだまだ課題が残されているが,今後もASOもしくは低分子化合物などによるスプライシング調節を標的とした治療ストラテジーはさらなる発展を遂げ,新たな医療に築いていくに違いない.