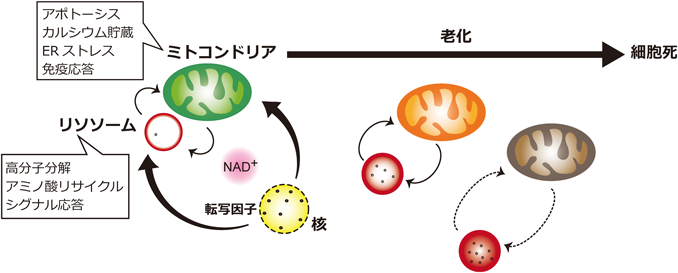
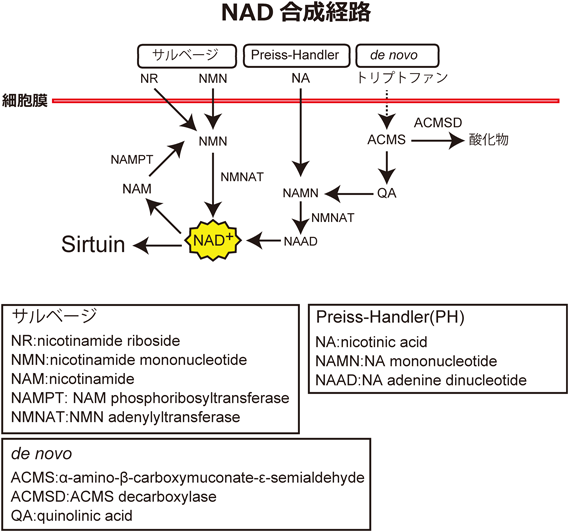
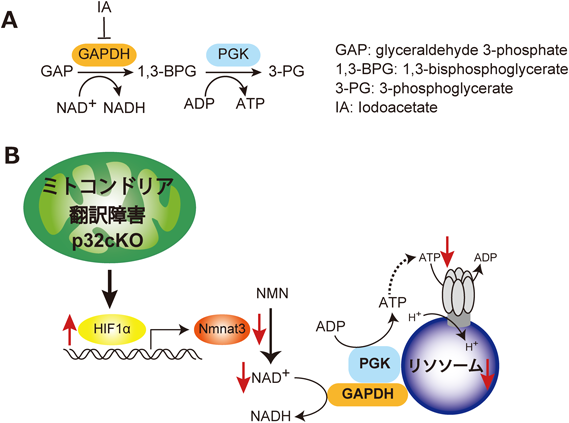
老化性疾患におけるミトコンドリアとリソソームのクロストークMitochondrial and lysosomal crosstalk in aging diseases
九州大学大学院医学研究院保健学部門Department of Health Sciences Graduate School of Medical Sciences Kyushu University ◇ 〒812–8582 福岡市東区馬出3–1–1 ◇ 3–1–1 Maidashi, Higashi-ku, Fukuoka 812–8582, Japan