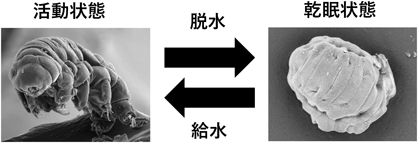
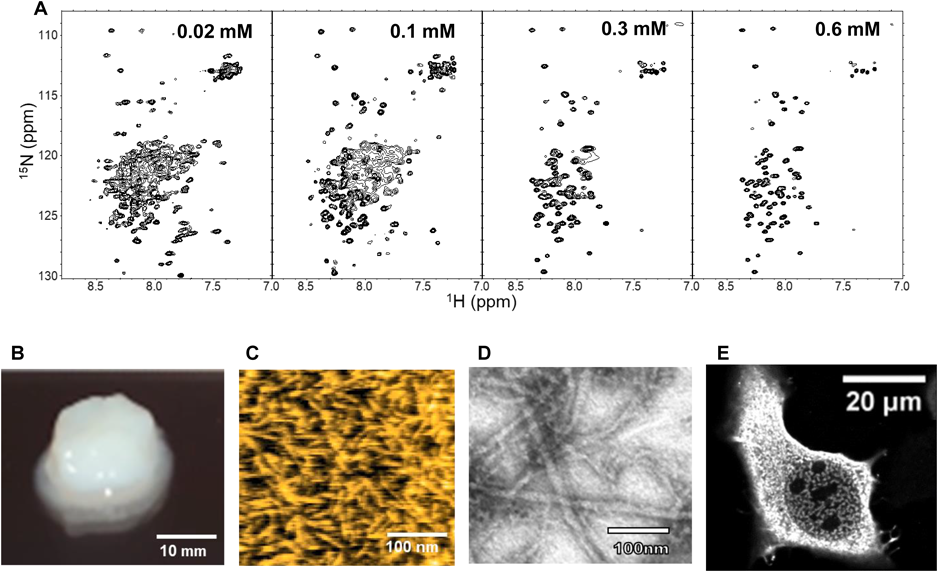
“地上最強生物”クマムシの乾眠の分子機構の解明に挑むTowards understanding the molecular mechanisms of anhydrobiosis in tardigrades, “the strongest organisms on earth”
1 名古屋市立大学大学院薬学研究科Graduate School of Pharmaceutical Sciences, Nagoya City University ◇ 〒467–8603 名古屋市瑞穂区田辺通3–1 ◇ 3–1 Tanabe-dori, Mizuho-ku, Nagoya 467–8603, Japan
2 自然科学研究機構生命創成探究センターExploratory Research Center on Life and Living Systems (ExCELLS), National Institutes of Natural Sciences ◇ 〒444–8787 愛知県岡崎市明大寺町東山5–1 ◇ 5–1 Higashiyama, Myodaiji, Okazaki, Aichi 444–8787, Japan