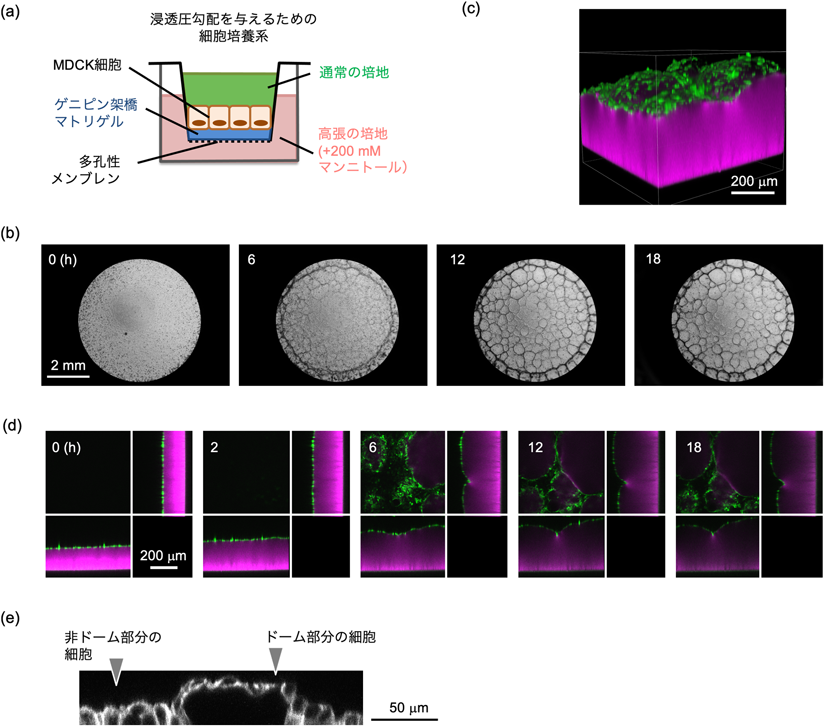
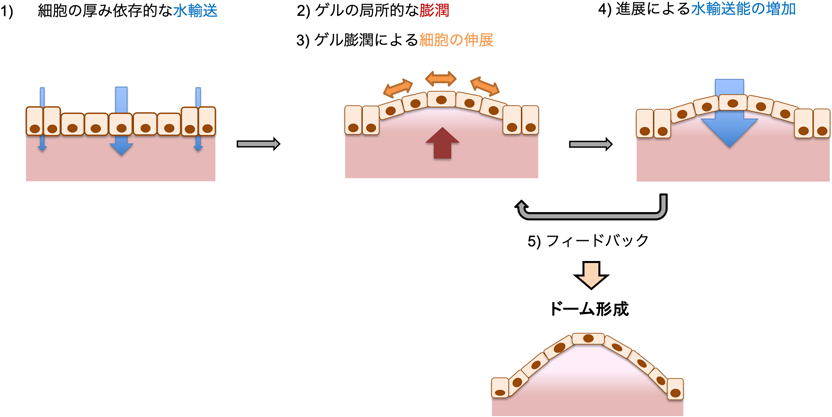
浸透圧勾配による上皮細胞シートおよび細胞外マトリクスの三次元形態形成Three-dimensional deformation of epithelial sheets on extracellular matrix induced by osmotic gradient
1 北海道大学大学院先端生命科学研究院生命機能科学研究部門細胞装置学研究室Laboratory of Cell Machinery Science, Faculty of Advanced Life Science, Hokkaido University ◇ 〒001–0021 北海道札幌市北区北21条西11丁目 ◇ Kita-21 Nishi-11, Kita-ku, Sapporo, Hokkaido 001–0021, Japan
2 北海道大学大学院先端生命科学研究院先端融合科学研究部門細胞ダイナミクス科学研究室Laboratory of Cell Dynamics, Faculty of Advanced Life Science, Hokkaido University ◇ 〒060–0810 北海道札幌市北区北10西8丁目 ◇ Kita-10 Nishi-8, Kita-ku, Sapporo, Hokkaido 060–0810, Japan