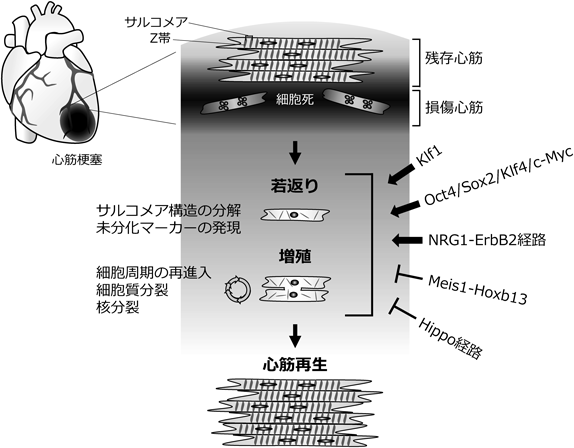
心筋細胞の若返りと増殖を制御する分子機構Molecular mechanisms regulating cardiomyocyte dedifferentiation and proliferation
国立循環器病研究センター研究所,心臓再生制御部Department of Cardiac Regeneration Biology, National Cerebral and Cardiovascular Center Research Institute ◇ 〒564–8565 大阪府吹田市岸部新町6–1 ◇ 6–1 Kishibe-Shimmachi, Suita, Osaka 564–8565, Japan