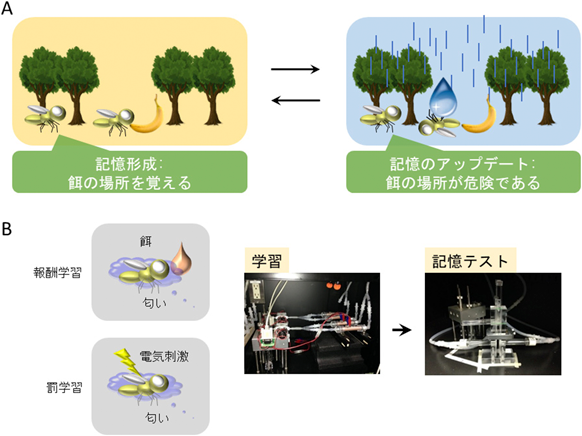
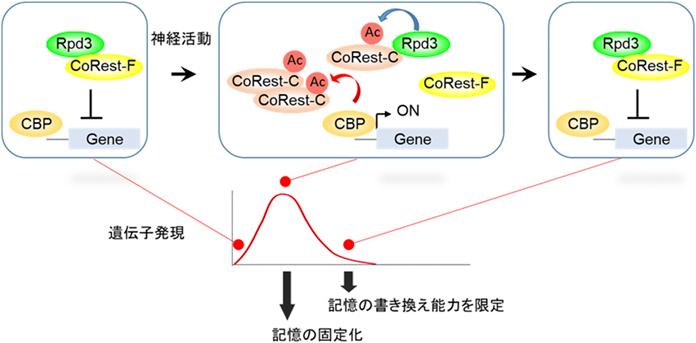
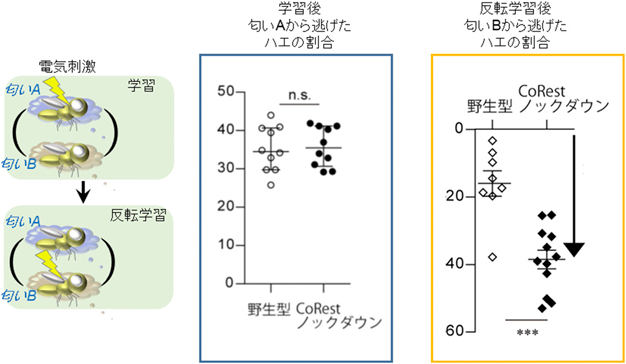
転写活性の時間的制御を介した記憶のアップデート機構Limiting time for transcription controls memory updating
香港科学技術大学The Hong Kong University of Science and Technology ◇ Tower D, room 5E, HKUST, Clear Water Bay, Sai Kung, Hong Kong ◇ Tower D, room 5E, HKUST, Clear Water Bay, Sai Kung, Hong Kong