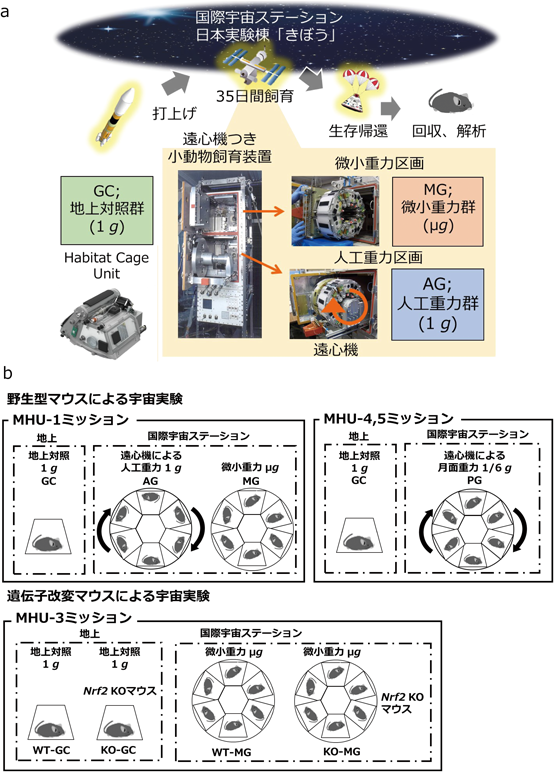
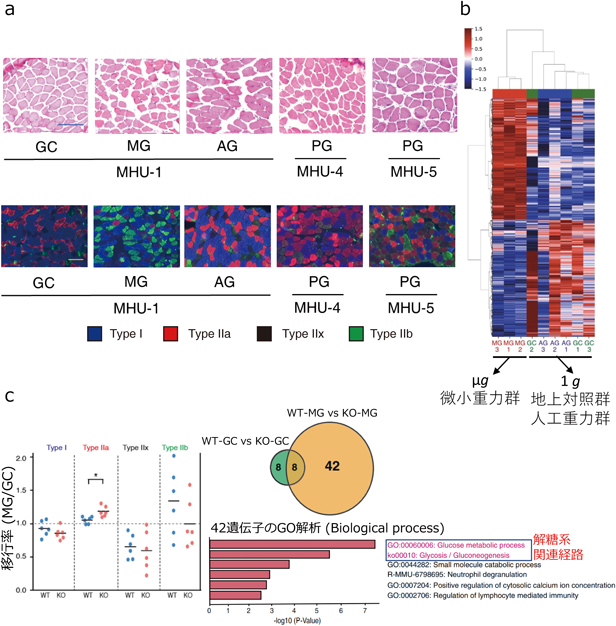
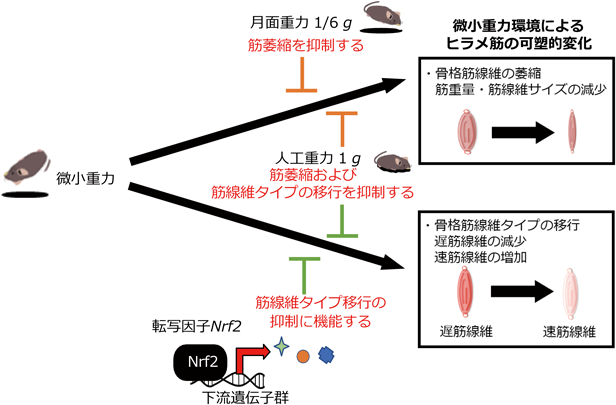
宇宙環境がもたらす骨格筋可塑性への影響Effects of the space environment on skeletal muscle plasticity
筑波大学医学医療系解剖学発生学研究室Department of Anatomy and Embryology, Faculty of Medicine, University of Tsukuba ◇ 〒305–8575 茨城県つくば市天王台1–1–1 ◇ 1–1–1 Tennodai, Tsukuba, Ibaraki 305–8575, Japan