Gタンパク質共役型受容体(GPCR)は,細胞の内外を隔てる細胞膜に局在して,さまざまな細胞外シグナルを受容する膜受容体の一群である.GPCRの受容する細胞外シグナルは,光やペプチド,脂質など多岐にわたる.このようなシグナルにより活性化されたGPCRは,細胞内に存在する三量体Gタンパク質やアレスチンを活性化することで,細胞外から細胞内への情報伝達を担う.
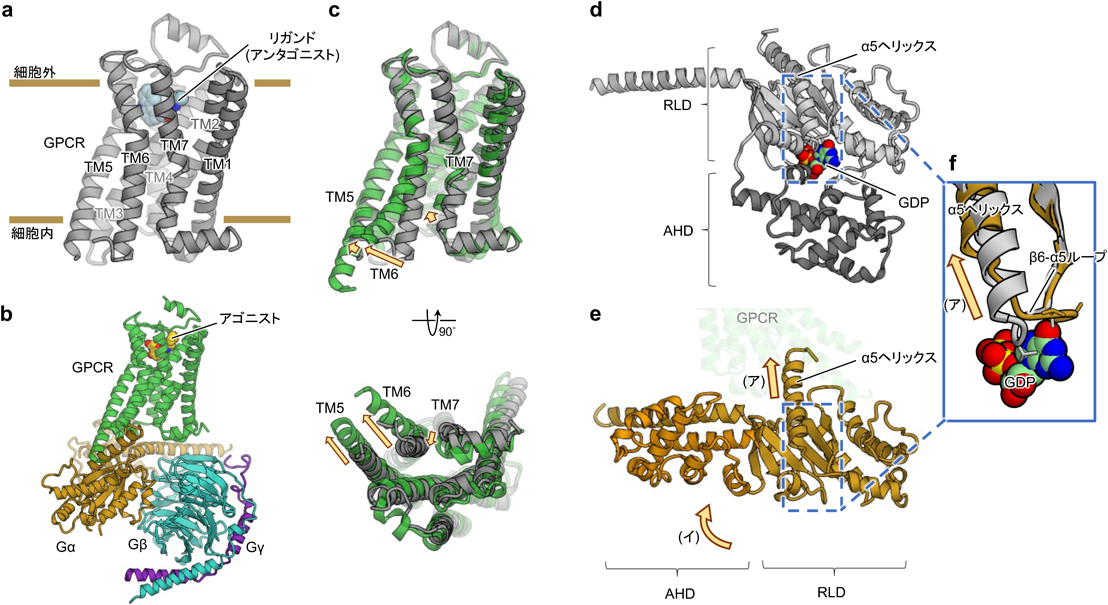
GPCRはヒトにおいて最大の膜受容体ファミリーを形成しているが,これはヒトの場合さらにクラスA, B, C, Fの四つのサブファミリーに分類される.このうち本稿で取り上げるクラスAは,全GPCRの85%が含まれる最大のサブファミリーである.GPCRとして最初期にクローニングされたロドプシンやアドレナリン受容体がクラスA GPCRであったこともあり,数多くのクラスA GPCRの医学・生理学・構造学的知見が蓄積されている.特に構造学的研究に着目すると,GPCR単体(図1a),および,GPCRとGタンパク質の複合体(図1b)は,いずれも現在までに100以上の立体構造が決定されてきた1).
本稿ではまず,これまでの研究からクラスA GPCRに共通すると考えられている受容体活性化機構について紹介する.次に,GPCRにより活性化される主要なシグナル因子である三量体Gタンパク質について,その活性化の分子機構を紹介する.最後に,近年著者らのグループが報告したクラスA GPCRの一種であるニューロテンシン受容体1(NTSR1)と三量体Gタンパク質の複合体構造をモデルに,本研究にて提唱したGPCRによるGタンパク質の活性化機構の一形態を紹介する.
三量体Gタンパク質は,Gα, Gβ, Gγの三つのサブユニットから構成される.三量体Gタンパク質は,リガンドによって活性化されたGPCRに結合し構造変化を生じる.これにより,三量体Gタンパク質はGαとGβγに解離し,それぞれがさらに下流のエフェクター因子を制御することでシグナル伝達を担う.ここでは,現在までに判明しているこの三量体Gタンパク質活性化の分子機構を詳しく解説する.
GPCRの種類や発現細胞によって,共役する三量体Gタンパク質の種類が異なることが知られており,これらはGαの配列から,Gi/o, Gq, Gs, G12/13の4種に大別される.すべてのGαは共通して,Ras様ドメイン(RLD)とαヘリカルドメイン(AHD)という二つのドメインを持つ.通常不活性型で存在する三量体Gタンパク質のRLDには,その核酸結合ポケットにグアノシン二リン酸(GDP)が結合している(図1d).三量体Gタンパク質は,アゴニストによって活性化されたGPCRに結合するとその構造に変化が生じ,GαからGDPが放出され,代わりにグアノシン三リン酸(GTP)が結合する.その結果,GαとGβの相互作用部位に構造変化が生じることでGTP結合型GαとGβγに解離し,アデニル酸シクラーゼやイオンチャネルなど下流のエフェクター因子との相互作用が可能となる.この一連の過程がGタンパク質の活性化である3).
ここで,GPCRとの複合体形成がどのように,GDPの放出やそれに伴うGTPの結合を引き起こすか説明する.鍵となるのは核酸結合ポケット周りの二つの構造変化である(図1d~f).(ア)不活性時のGαのβ6-α5ループは,GDPと直接相互作用する核酸結合ポケットの一部である.このβ6-α5ループのC末端はα5ヘリックスにつながっており,GPCRとの複合体形成時,このα5ヘリックスはGPCR内部に移動する.α5ヘリックスの移動に伴いβ6-α5ループが構造変化を起こし,GDPとの相互作用が失われる.(イ)不活性型Gタンパク質において,RLD上に存在する核酸結合ポケットはAHDに「蓋」をされている.Gタンパク質がGPCRと複合体を形成すると,AHDとRLDとの相互作用が弱まり,RLDからAHDが解離する.AHDの解離によって核酸結合ポケットは溶媒に露出し,GDPは放出されやすくなる.このように(ア)核酸結合部位が構造変化し(イ)核酸結合ポケットを覆う「蓋」が外れるという2条件を満たすことがGDPの放出に重要であるという考えは,分子動力学(MD)シミュレーションをはじめとするさまざまな研究により支持されている4).
4. NTSR1-Gi複合体構造とNTSR1によるGi活性化機構
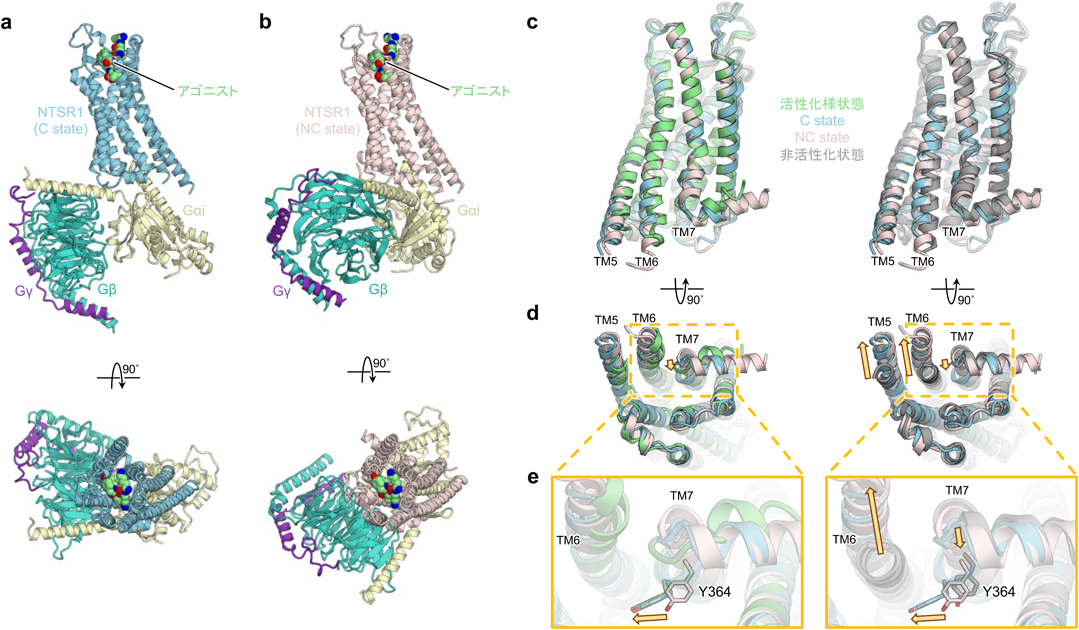
NTSR1は1990年に京都大学の中西重忠博士らにより発見されたクラスA GPCRの一種であり,ホルモンや神経伝達物質として働くペプチドであるニューロテンシンにより活性化される5).NTSR1は体温や血圧の調節,食欲や痛覚の制御,パーキンソン病や統合失調症など多様な生理機能および疾患に関わり6),この多様さを裏づけるかのように4種Gタンパク質すべてを活性化する特性を持つ7).これまでに,X線結晶構造解析によってNTSR1単体の非活性化様状態および活性化様状態の立体構造が報告されてきたが8, 9),Gタンパク質との複合体構造は長らく不明であった.そのような状況下で我々は近年,クライオ電子顕微鏡を用いた単粒子解析によりヒト由来NTSR1と三量体Gタンパク質の一種であるGiとの複合体(NTSR1-Gi複合体)の立体構造を分解能3.0 Åで決定することに成功した10).興味深いことに,本研究では二つの異なるNTSR1-Gi複合体の構造が得られた.一つ目の構造は,これまで報告されてきた他のクラスA GPCRとGiの複合体と全体構造がよく一致した[canonical state(C state)](図2a).これに対して,二つ目の構造では,GPCRに対するGタンパク質全体の向きがC stateに比べ45°回転しているという大きな構造の違いがみられた(図2a, 2b下図).これはこれまで報告されたことのない特徴を有するGPCR-Gタンパク質複合体構造であったことから,我々はnon-canonical state(NC state)と名づけた(図2b).以下ではC stateとNC stateの構造を,1)受容体の構造,2)Giの構造,3)受容体とGiの相互作用界面の三つに分けて,比較と考察をした結果をもとに4)NTSR1によるGi活性化モデルを提唱する.
1)受容体の構造
まず,C state, NC stateにおける受容体の構造を,すでに報告されている活性化様状態,非活性化様状態と比較した(図2c~e).C state, NC stateともに受容体の全体構造は活性化様状態に近く,TM5, TM6の外側への屈曲がみられた(図2d).しかしながら2状態のTM7の構造は,GPCRの活性化に重要とされるNPxxYモチーフも含め違いがみられた.C stateのTM7が内側へ屈曲しNPxxYモチーフに含まれるY364が活性化様状態と類似の構造をとる一方,NC stateのTM7はY364も含め非活性化様状態に近い構造をとっていた(図2d, e).このようにC stateの構造が全体として活性化状態の特徴を示す一方,NC stateの構造は,活性化状態,非活性化状態の特徴を併せ持っていた.このNC stateの特徴が先行研究のMDシミュレーションにより報告されたGPCRの中間体状態11)に類似することから,我々はこれが活性化の過程で生じる中間状態であるという仮説を立てた.この仮説を検証するため,C stateのNTSR1-Gi複合体からGiを取り除いたMDシミュレーションを実施した.これはNTSR1が三量体Gタンパク質の結合した活性化状態から非活性化状態へと遷移する過程を捉える意図で実施したものである.結果としてはC stateから非活性化状態への遷移中にNC state様の構造を経由した.これによりNC stateが受容体活性化までの中間状態であるという仮説が支持された.
2)Giの構造
Giの構造は,C stateとNC stateのいずれにおいてもすでに報告されている他のGPCR-Gi複合体におけるGiの構造と酷似しており,核酸結合ポケットにGDPに由来する密度は確認されなかった.しかしながら,このポケットを形成するβ6-α5ループには2状態間で違いがみられた.NC stateと比較して,C stateにおけるβ6-α5ループの電子顕微鏡密度マップは顕著に弱く,その構造的柔軟性が高いことを示唆していた.この柔軟性を支持するように,MDシミュレーションにおいてもC stateの方がβ6-α5ループの動きが大きいという結果が得られた.β6-α5ループの大きな動きは核酸結合ポケットの溶媒露出領域を増やすことが予想され,実際にMDシミュレーションにおけるその溶媒露出領域を計算したところ,C stateの方が大きいことがわかった.核酸結合ポケットの溶媒露出領域が大きいほど,ポケットへのGTPの流入確率が高いと考えられ,C stateにおいてGTPの結合が促進されることが示唆された.
3)受容体とGiの相互作用界面
C state, NC stateにおけるNTSR1とGiの相互作用界面の違いを比較した.C stateにおいては,主にGαのα5ヘリックスと受容体のTM3, 5, 6, 7など,これまで報告されたGPCR-Gi複合体と同様の相互作用がみられた.一方,NC stateのα5ヘリックスとの相互作用は,主にα5ヘリックスとTM6に集中した.加えて,NC stateではGαのみならずGβと受容体の相互作用がみられるなど,Giの回転による相互作用界面の劇的な変化がみられた.そこで,我々はNC stateに特異的な相互作用を消失させることでNC stateの生理的重要性を明らかにしようと考え,NC stateでのみ相互作用のみられる4残基をアラニンに置換したNTSR1の変異体を作製し,NanoBiT Gタンパク質解離アッセイ12)を行った.このアッセイでは,ルシフェラーゼのN末端,C末端断片を,GαとGβにそれぞれ融合させることで,GαとGβγの解離つまりGタンパク質の活性化を発光強度の変化でみることができる.アッセイの結果,NTSR1の4残基変異体では,Gq, Gs, G13を野生型と同等に活性化できる一方,Gi/oでのみ活性化能が顕著に低下することが判明した.これにより,NC stateはGi/o活性化時にのみ存在する中間状態であり,その形成は生理的に重要であると示唆された.
4)NTSR1によるGi活性化機構のモデル
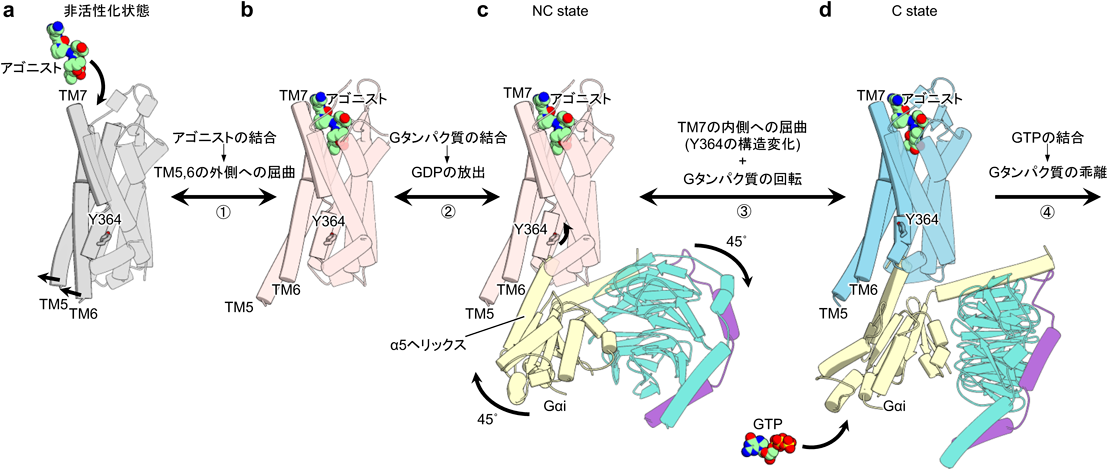
1~3)の結果から,NTSR1によるGiの以下の経時的活性化モデルを提唱した(図3).①まず,アゴニストがリガンド結合部位に結合することによりTM5, TM6が外側に屈曲する.この構造変化により受容体の細胞内側にGiのα5ヘリックスを収容するスペースができる.②主にα5ヘリックスとTM6の相互作用によりGiがNTSR1に結合し,NC stateのNTSR1-Gi複合体を形成する.その結果α5ヘリックスがNTSR1内部へと移動し,β6-α5ループの構造変化,GDPの放出へとつながる.③TM7,特にY364が内側に動き,Giの受容体に対する45°の回転が生じる.④C stateに到達することで生じやすくなったGiへのGTP結合と,それに伴うGiの解離が引き起こされる.
ここまで,中間状態と考えられるNC stateを用いてNTSR1によるGi活性化モデルを議論してきたが,このNC stateはラット由来NTSR1-Gi複合体の構造決定に成功した別のグループからも近年報告されており,我々の仮説が補強された形となっている13).さらに,MDシミュレーションと機械学習を組み合わせた研究によりさまざまなNTSR1の中間状態が捉えられている14)など,NTSR1は中間状態解析のモデルGPCRになりつつある.また,NTSR1はGタンパク質のみならず,もう一つの重要なエフェクター因子であるアレスチンの活性化においても特殊な認識機構を有することが近年の研究で判明しており,Gタンパク質活性化,アレスチン活性化,バイアスシグナルといったさまざまな観点から注目を浴びるようになってきている15, 16).今後,NTSR1を用いた研究はますます盛んになっていくだろう.