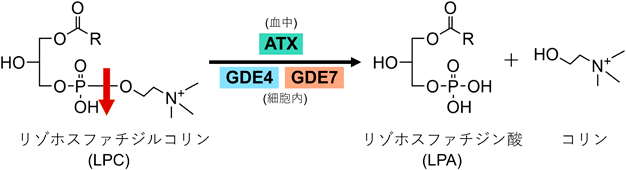
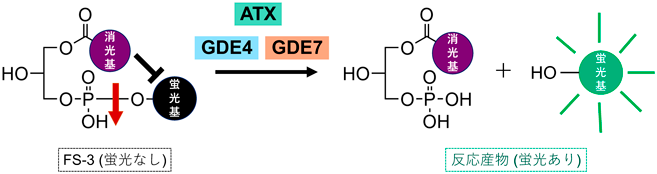
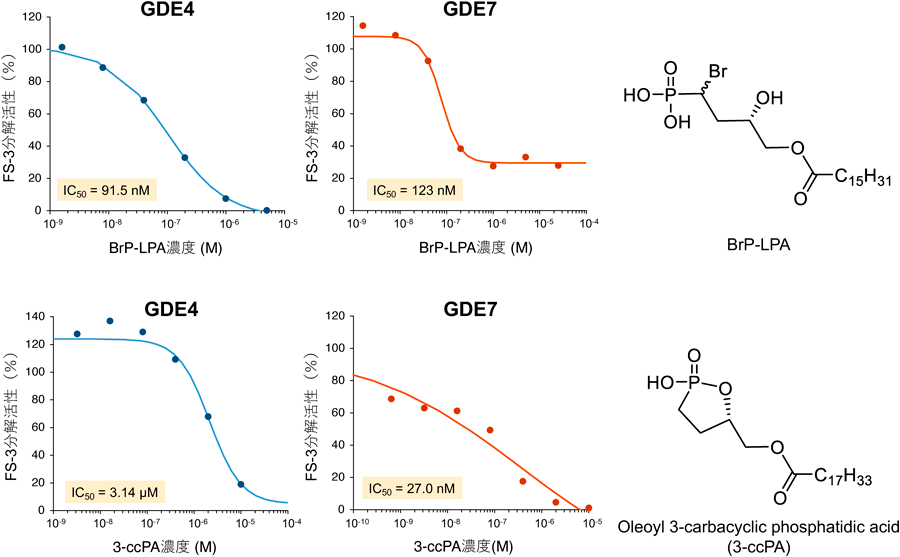
蛍光基質を用いた簡便なグリセロホスホジエステラーゼGDE4およびGDE7の活性測定法A simple enzyme assay for glycerophosphodiesterase GDE4 and GDE7 using fluorescent substrate
川崎医科大学薬理学教室Department of Pharmacology, Kawasaki Medical School ◇ 〒701–0192 岡山県倉敷市松島577 ◇ 577 Matsushima, Kurashiki, Okayama 701–0192, Japan