科学の基本は発見である.新しいものを発見すること,新しい現象を発見すること,それが研究で一番面白い.粘り強く,こつこつと働く日本人には「発見すること」が性に合っているのだろう.筆者が研究を始めたころには,一流雑誌には日本人研究者による発見の記録が毎号のように掲載されていた.しかし科学は進化し,一つの分子を発見して,それに焦点をあてた要素還元主義的な研究を超えて,現象の全体像を解釈する全体論的な研究にシフトしてきた.この総説は「発見」の時代の終わり近く(と思う)に,筆者らが発見したグレリンに関する記録である.
グレリンの発見までには40年以上の長い歴史がある.グレリン研究(もちろんターゲットのホルモンは,まだグレリンという名ではない)に関する最初の報告は,1954年の胃に存在する新規の内分泌細胞の報告である(図1).リバプール大学のDavisによる「The relation between the pancreatic alpha cells and certain cells in the gastric mucosa(膵臓α細胞と,胃粘膜にある未知の細胞との関連)」というタイトルの論文では,膵臓のα細胞に似た,胃のX細胞について論じている1).このX細胞が細胞内にどのようなホルモンを貯蔵しているのかは,グレリンが発見されるまで長い間不明であった.グレリン発見後に明らかになったのだが,膵臓のα細胞もグレリンを産生・分泌しており,グレリンを分泌する二つの細胞,膵臓のα細胞と胃のX細胞が,似通った形態の細胞であることは興味深い.
1970年代後半になって,成長ホルモン分泌促進活性を持つ化合物として,さまざまな成長ホルモン分泌促進因子(growth hormone secretagogue:GHS)が開発された2).そのきっかけはオピオイドペプチドの発見である.1975年にHughresらによって,メチオニンエンケファリンとロイシンエンケファリンの二つのオピオイドペプチドが脳内から発見された.このエンケファリンの構造を基に,チューレーン大学のBowersらは(おそらく強い鎮痛作用のオピオイド誘導体を合成していたのだろう),その誘導体の一つであるTyr-D-Trp-Gly-Phe-Met-NH2が弱いながら成長ホルモン分泌促進活性を持つことを見いだした.この成長ホルモン分泌促進活性を持つオピオイド誘導体をベースに改良が重ねられ,次第により強い成長ホルモン分泌促進活性を持つペプチド誘導体が開発された.その代表的なものがGHRP-6(His-D-Trp-Ala-D-Trp-Phe-Lys-NH2)である.
その後,当時メルク社にいたSmithらによって経口投与可能な非ペプチド性低分子化合物のGHS(L-692,429)が1993年に開発された3).それとともに,GHSがどのようなメカニズムで成長ホルモンの分泌を刺激するのか,その解明も進んでいた.1989年にはChengらによって,GHRP-6が成長ホルモン放出因子(growth hormone releasing factor:GRF)とは異なる受容体を介して作用することが示唆された4).そして1996年にメルク社のチームによってGHS受容体がクローニングされ,確かにGHSには特異的な受容体が存在することが明らかになった5).
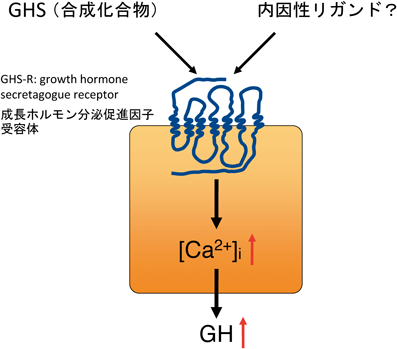
GHSは成長ホルモン分泌促進活性を持つ,天然にはない化合物の総称である.それなのに特異的な受容体が存在するということは,生体内にはこの受容体に結合する内因性のリガンドが存在することを示唆している(図2).この内因性リガンドこそがグレリンである.
GHS受容体のクローニング論文が発表されたとき,私は受容体型グアニル酸シクラーゼの内因性リガンド探索を行っていた.受容体型グアニル酸シクラーゼの代表的なものはナトリウム利尿ペプチドが内因性リガンドであるGC-A(ANP, BNPが内因性リガンド)とGC-B(CNPが内因性リガンド)である.その他には腸管での水電解質代謝に関与するGC-Cが知られており,その内因性リガンドはグアニリン(guanylin)とウログアニリン(uroguanylin)と同定されていた.現在,このGC-Cは便秘薬リナクロチド(商品名「リンゼス」)のターゲットである.当時,受容体型グアニル酸シクラーゼはこの三つ以外はほとんど研究されておらず,新規の受容体型グアニル酸シクラーゼの内因性リガンドは,新規のペプチドホルモンであることが予想された.
1980年代当時はまだ遺伝子やタンパク質のデータベースなど十分でなく,リガンド探索のターゲットとなる受容体型グアニル酸シクラーゼを,まず自らクローニングしなければならなかった.新しい受容体型グアニル酸シクラーゼのクローニングだけでも一つの論文になった時代だった.我々は嗅覚に発現しているGC-Dや,網膜に発現しているGC-EとGC-Fを見つけていたのだが,そのcDNAの全長は長く,全塩基配列を決めるのに非常に苦労していた.残念ながらこれらの新規受容体型グアニル酸シクラーゼのクローニングは,当時ヴァンダービルト大学にいたGarbers(故人)のグループにことごとく先に発表され,悔しい思いをした6).気を取り直してGC-E, GC-Fをターゲットにして網膜から未知の内因性リガンドを探索することにした.細胞内cGMPの変動を指標としたグアニル酸シクラーゼの内因性リガンド探索の研究を5年間くらい続けたが,結局,リガンドは見つからず「このままじゃ,いかんよな」と思い始めた.
そのころPCRを使ったDNAの解析技術が進歩して,既知のGタンパク質共役受容体(G-protein-coupled receptor:GPCR)のアミノ酸配列を基に,degenerativeプライマーを用いて,新しいGPCRのクローニングが盛んに行われていた.当時報告されたGPCRのほとんどは,結合するリガンドが不明のオーファンGPCRであった.このようなオーファンGPCRをターゲットにして,新しいペプチドホルモンが次々と発見されていた.その最初はカリフォルニア大学アーバイン校のCivelliたちによるオーファニンFQ(今ではノシセプチンと呼ばれる方が多い)だった7).私はCivelliらのScienceに発表された論文を読んで,とても刺激を受けた.さらに武田薬品グループのプロラクチン放出ホルモンや,テキサス大学(当時)柳沢グループによるオレキシンの発見など,オーファンGPCRのリガンド発見論文はどれもが私を興奮させる研究結果だった8, 9).自分がやっていた受容体型グアニル酸シクラーゼは思ったほど遺伝子の数は多くなく(七つしかなかった),新しいペプチドホルモンを見つけるには,やはりオーファンGPCRをターゲットにする方がよいと判断して方向転換した.
リガンド探索の結果は出なかったが,受容体型グアニル酸シクラーゼの研究によって,受容体遺伝子を発現する安定発現細胞株の樹立方法やアッセイ方法をマスターしたことは,そのあとの研究では大いに役に立った.
ターゲットとするGPCRの選択には困ることはなかった.続々と新規のオーファンGPCRのクローニング論文が発表されており,そのなかから面白そうなもの,特に既知のペプチドホルモン受容体に似たものを選んで,発現ベクターを構築した.このときに選んだものは10種類くらいあったが,現在でもそのほとんどはリガンドが不明なままである.
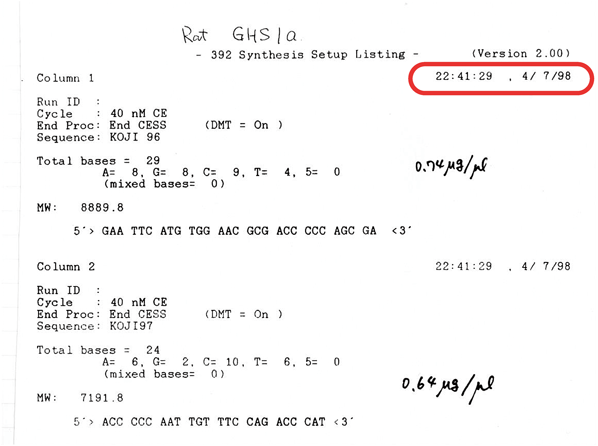
実はグレリン受容体であるGHS受容体は,最初に選んだものではなかった.自分の無知さから,原論文を知らなかったのだ.正確にいうと,読んでいたのだが注目していなかった5).それはScienceに1996年に発表された論文で,確かに読んだ(見た)記憶はあった.成長ホルモン放出因子の受容体のクローニング論文だったが,成長ホルモン放出因子がてっきりGRF(成長ホルモン促進因子)のことだと思っていて,「なぜ今ごろ,GRF受容体のクローニング論文がScienceに?」と疑問に感じた.ところが,オーファンGPCRのクローニング論文を片っ端から読んで,よいターゲットの受容体を探していたときに,再びそのScienceの論文に遭遇したのだ.それは1998年4月7日であることが,ノートに書かれた記録からわかる(図3).なぜかというと,GHS受容体論文を読んだのが,夕食を食べて研究室に帰ってきてからのことで,論文を読んで「これこそターゲットにふさわしい」と興奮し,その夜のうちにGHS受容体の発現ベクターの構築のために,PCRプライマーの合成を始めたからだ(当時は,自分たちでPCRプライマーを合成して使っていた).
GHS受容体こそがターゲットにふさわしいことは,この受容体には合成リガンド(GHS)が存在したからだ.つまり合成リガンドを用いるとGHS受容体発現細胞のアッセイ系がきちんと動くのかがチェックできる.それまでのオーファンGPCRのアッセイ系は,一応mRNAで受容体遺伝子の発現はチェックしていたのだが,タンパク質レベルで機能しているのかは確かめようがなかった.受容体によってはたとえタンパク質として合成されても,細胞内で凝縮して,うまく細胞表面にソーティングされていない可能性もあった.そのためオーファンGPCRのアッセイ系(GPCRを介した細胞内シグナル変動を指標)は,闇の中を手探りで,うまくアッセイできるのか確信を持たないまま進むようなものだった.それがGHS受容体ならば合成GHSを使えば,アッセイ系が動くことがチェックできる.しかも合成GHSはいくつかが市販されている.GHS受容体は,視床下部,下垂体に発現していることから,我々は,脳から内因性リガンドの探索を開始した.
脳においてGHS受容体の内因性リガンド探索では,いくつかの活性のあるペプチド断片を精製したが,これらはいずれもタンパク質の切れ端で(たとえばプルキンエ細胞タンパク質2,ミエリン塩基性タンパク質など),比活性(細胞内カルシウムの上昇)も弱く,真のリガンドではなかった.
1999年1月,GHS受容体のアッセイを開始して,早くも1年近くになろうとしていたが,まったく先の展望がみえなかった.私と大学院生の細田洋司君(現・信州大学医学部)は来る日も来る日も,クロマトグラフィーとアッセイを続け,すでに500回を超えるアッセイを行っていたが,まったく何の手がかりも得られていなかった.脳以外の組織も調べてみようかと思い始めていたが,脳をあきらめるのにはものすごく勇気がいった.おそらく,他の研究グループも同じ考えだったろうが,GHS受容体の分布からは,内因性リガンドの存在部位として脳が最も可能性の高い組織だったからだ.
当時GHS受容体にホモロジーが高い,やはりオーファン受容体にGPR38が知られていた10).GPR38はその後モチリン受容体と同定されたのだが,その時点ではやはりGHS受容体と同じく内因性リガンドは不明だった.手詰まりの状況のなかで,私はGHS受容体とGPR38はファミリーなのだから,それぞれのリガンドは他方の受容体に交叉反応するだろうと考えた.GPR38のリガンド構造がわかれば,GHS受容体のリガンド構造にも何かヒントが得られるだろう.運がよければ遺伝子データベースのホモロジー検索から,GHS受容休リガンドの構造もわかるかもしれないと期待した.
GPR38は胃および甲状腺に多く発現していた.そこでGPR38の発現細胞系を作るためにGPR38のcDNAをPCRで増やそうとしたのだが,うまくいかない.並行して進めていた胃のペプチド抽出サンプルができ上がったので,先に胃のサンプルをGHS受容体発現細胞株でアッセイすることにした.図4は1999年2月9日,胃ペプチド抽出物のゲル濾過カラムサンプルの1回目のアッセイ結果である.全フラクションで強い細胞内力ルシウムの上昇がみられたため,これは何か変なことが起こっているに違いないと考えた(図4左).ちょうどその1週間前に,別のオーファン受容体発現細胞のアッセイで,細胞が壊れて細胞内のカルシウムイオンが流出し,全フラクションで細胞内カルシウム上昇がみられるという経験をしていたのだ.胃にはなにか細胞を壊すような活性を持ったペプチドでも存在するのかなと考え,胃のサンプルはひとまず置いておき,別の組織のアッセイに取りかかった.それでも活性らしきものは見つけることができず,毎日,その日のアッセイ結果と過去のアッセイデータとを丹念にチェックしていた.
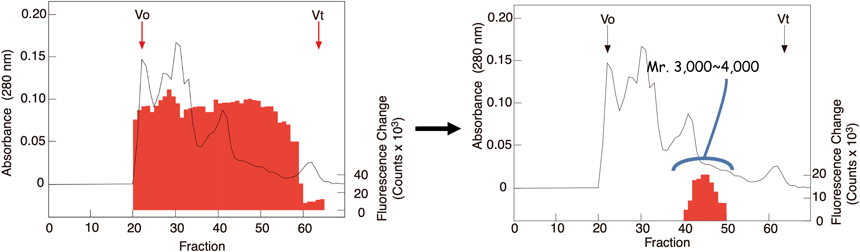
3週間くらいして,再び胃のアッセイを,今度はサンプル量を以前の1/10で行った.結果は前回と同じで,全フラクションに強い細胞内カルシウム上昇がみられた.やはり,胃にはなにか変な細胞を壊すような物質があるに違いないと,再び胃のサンプルはそのまま置いておいた.さらに行き詰まった1か月後の3月中旬,データを見直していたとき,「もしかすると胃にはGHS受容体のリガンドがものすごく多量に存在するのでは」と気づき,今度はサンプル量をぐっと少なくしてアッセイしてみた.すると活性は分子量約3000~4000くらいのところに,きれいにまとまるではないか(図4右).つまりゲル濾過のビーク解像度はそれほど高くないため,これまでのアッセイでは全フラクションで反応が頭打ちになるほど多量のサンプルを使ってアッセイをしていたのだ.わずか数mgの組織抽出物からでも活性が測定できるほど,ものすごく多量のリガンドが胃に存在していた.胃から成長ホルモンの分泌を促進するペプチドが分泌されることは驚きだった.リガンドは微量にしか存在しないのだろうとか,成長ホルモン分泌は脳によって制御されているという先入観によって,すぐに気づかなかった自分が情けなかった.
我々は喜び勇んで精製を進めた.わずか数gのラット胃組織抽出物から,ほんの10日ほどで精製は完了した.3月30日だった.
それから我々は今まで以上に実験をした.シークエンサーでアミノ酸配列を解析すると,3番目のアミノ酸が同定できない.同時に行っていたcDNAの解析からは,3番目のアミノ酸はセリン残基だった.なぜ,セリン残基が同定できないのだろうか? 疑問に思いながらも,ともかく3番目をセリンとしてペプチド合成した.そして合成したペプチドの活性を調べた.しかし活性がまったくない.何度やっても同じだった.しかもHPLCで,合成したペプチドと精製したペプチドの溶出時間がかなり異なる.精製したピークに含まれるマイナー成分が真の活性なのだろうか? いや,活性に必要な量から推測すると,精製したペプチド以上に強い活性のマイナー成分はありそうになかった.つまり,3番目のセリン残基が何かの分子で修飾を受けており,この分子が活性発現に必要なのだろう.
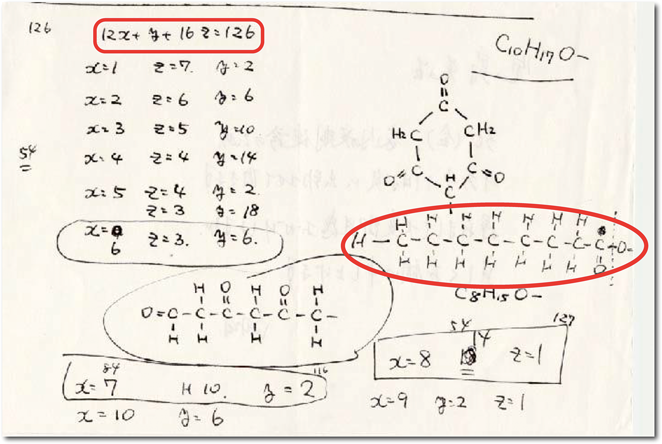
この修飾基の構造は一体何なのだろう? 質量分析計による分子量測定では,精製したペプチドは,合成したペプチドより分子量が126だけ大きかった.つまり分子量126の分子がセリン残基を修飾しており,この修飾基が活性発現に必須なのだ.これまで知られているペプチドの修飾基構造,たとえばリン酸基やスルホニル基では分子量が合わない.アミノ酸,糖質,金属などにも分子量が一致する物質はなかった.
その間にラット,ヒトのcDNA解析を1週間ほどで終え,各組織のノーザンブロットで胃がメインの発現部位だと確認した.修飾基とは関係のないペプチドのC末端部分を使って,抗体もすでに作製を始めていた.しかし肝心の活性構造がわからず,活性のあるペプチドを合成できない状況では生理実験はできなかった.これまでの合成GHS研究の蓄積から,このリガンドの成長ホルモン分泌促進活性は明らかであるにもかかわらずだ.
私,細田君と寒川賢治部長の3人は,土曜日も日曜祝日も研究室に出てきては,昨夜の間に何かアイデアが浮かんだか話しあったが,糸口はつかめなかった.その時点でできうる実験はすべて終えており,3人とも何をするともなしに研究室をうろうろしていた.こんなに大量に存在するペプチドなのだから,ほかのグループも精製に成功しているに違いない.修飾基の構造を解明して,もしかしたらもう論文を投稿しているかもしれないと不安になった.先に発表されれば,その時点で我々の苦労も水の泡だからだ.我々はこの修飾基の構造がわからなければ発表もできないし,かといって時間が経てば構造がわかるという保証などまったくなかった.このまま構造は永久にわからないままなのではと,不安にかられる毎日だった.
精製完了からすでに1か月以上経過しても,修飾基の構造は依然としてわからなかった.5月のゴールデンウィークになっていた.実家に帰る用があり,電車のなかでぼんやりと修飾基の構造について考えていた.分子量126が頭から離れなかった.126, 126….ある瞬間にひらめいた.もしこの修飾基が有機化合物なら,12X+Y+16Z=126という簡単な数式で解けるのではないか.Xは炭素数,Yは水素数,Zは酸素数,合計が分子量126.この方程式は高校数学程度の簡単なもので,X, Y, Zの場合の数を考えればすぐに解ける.しかも解は何通りかに限られるから,化合物の構造もある程度にしぼれるのではないか(図5).手帳に書いて計算してみると,うまくいきそうだ.翌日研究室へ行って,寒川部長にこうやれば解けるのではないかと,昨日電車のなかで思いついた計算式を説明した.
方程式のいくつかの解から,考えられる化合物を書き出し検討した.私は「六角環の化合物が美しいから,これじゃないか」というと,寒川部長は「こんな構造があるわけがない,むしろこの脂肪酸が実験結果と合うのではないか」と,さすがに専門の有機化学の知識が豊富である.この脂肪酸のオクタン酸なら生体内でも合成されるだろうし,精製した天然のペプチドがHPLC上で溶出時間が遅い,つまり疎水性が強いことも説明できる.「これだ,これしかない」とさっそくペプチド合成を近くのペプチド研究所に依頼することになった.脂肪酸で修飾されたペプチドの合成は,我々には手に負えなかったのだが,さすがに向こうはペプチド合成のプロ.何の問題もなく,合成できると断言してくれた.それでもこのような,これまでにまったく報告もない,奇妙な構造のペプチドをよく合成してくれたものだ.もっとも,「紙の上の推測だけで,こんな奇妙な構造のペプチドをよく合成依頼したものだ」と,構造解明に成功してから恩師の故松尾壽之先生(当時・循環器病センター名誉研究所長)にあきれられたことを覚えている.
6月初旬に合成ができたとの連絡がペプチド研究所からあった.暑い日だった.自転車で合成サンプルを取りに行った.研究所に戻り,さっそく天然精製物と合成ペプチドを混合して,HPLCで溶出をチェックした.クロマトグラフィーのチャートをじっと見ている間,不思議と不安感はなかった.この構造しかないと確信していたからだ.記録計のペン先が動き出す.ピークの出始めだ.やった,完全にピークが一致した.この構造で間違いない.
翌日にはGHS受容体の発現細胞で活性をチェックした.活性は完全に天然物と一致した.物理化学的な検討でも精製ペプチドと合成ペプチドとは一致した.脂肪酸で修飾された生理活性ペプチド,しかも,この修飾構造が活性発現に必要なのだ(図6).これまで誰も知らない謎を解き明かしたことで幸せいっぱいだった.
合成ペプチドを使った生理実験もすぐに始めた.並行して論文も書き始めた.おもしろいように文章が湧いて出て,書くのが楽しかった.1か月くらいで生理実験を順調に終え,論文もほぼでき上がった.投稿先はNatureをねらった.発見したペプチドの名前だが,研究社の英和辞典で調べて,“grow”の語源がインド・ヨーロッパ基語で“ghre”とのことから,これに生理活性ペプチドの命名によく使われる接尾語“in”をつけて,“ghrelin”と名づけた.これには“gh”,すなわちgrowth hormone(成長ホルモン)を“release”する意味も含まれ,いい名前だと自負した.もっともこのような名前がはたして欧米人に通じるか,知り合いの米国人の先生にたずねたところ,問題ないとの返事だったので安心した.ただし日本人泣かせの発音ではあるが.
7月中旬の軽井沢での小さな研究会から帰って,論文の最終的なチェックをしてNatureに投稿した(当時はまだ電子投稿ではなかった).最初の投稿時の著者は私,細田君,松尾先生,寒川部長の国立循環器病センターの4名だった.投稿してから久しぶりの休みをとった.もし投稿論文がレフェリーまでまわされないで,エディター却下なら1週間くらいで返事が来るだろうが,それはないだろうという自信があった.
8月も過ぎ,9月1日にNatureからの返事が来た.なんと4名ものレフェリーからのコメントがあったが,いずれも非常に好意的でNatureに掲載すべきだとコメントしてあった.飛び上がるようにうれしかった.ただ図や文章など細かな変更点を求められたのと,レフェリーヘの返事に視床下部でのグレリンの存在を示唆したところ,次のreviseではエディターからそのデータを要求された.我々はすでにグレリン抗体を作製しており,その時点で別の論文のために,宮崎医大の中里雅光先生(当時)に免疫染色を依頼していた.そして,グレリンの組織分布は別の論文にまとめようと予定していたため,組織の写真は別の論文で発表するから載せられないと返答した.9月20日に返ってきたエディターからのコメントは,免疫染色の結果は論文受理に絶対必要だとの強い返答だった.おまけにレフェリーが1人増え,合計5名になった.グレリンと成長ホルモン放出ホルモン(GHRH)の作用の比較図を加え,免疫染色に関しては,中里先生に無理をいって今回の論文に加えさせてもらった.10月2日,これで最後のリバイスになるようにと,祈りながら投稿した.そして10月11日にアクセプトのファックスをもらった(当時は電子メールではなく,ファックスだった)11).Natureに論文がアクセプトされた喜びよりも,我々のグレリンを世に送り出せることが決まって,ホッとした気持ちの方が強かった.
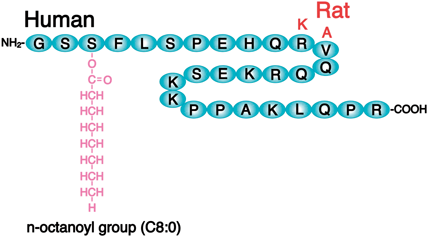
発見されたグレリンはオクタン酸などの中鎖脂肪酸で修飾されており,この脂肪酸修飾基は活性発現に必要である.現在のところグレリンだけが脂肪酸の修飾によって活性を発現する唯一のペプチドホルモンである.グレリンの3番目のセリン残基にオクタン酸を転移させる特異的な酵素が知られており,これがグレリン脂肪酸転移酵素(ghrelin O-acyltransferase,略してGOAT)である.
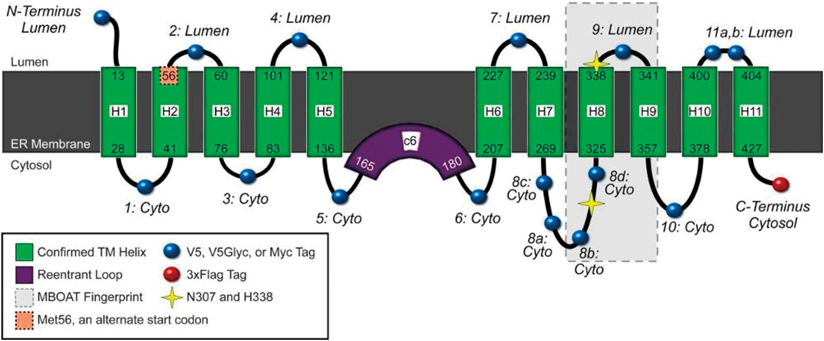
GOATは11回の膜貫通領域を持つ,膜結合型の酵素である.図7のような膜内でのトポロジーが想定されている12).ホモロジーのある膜タンパク質としてグラム陽性細菌のDltB(細胞壁のタイコ酸のD-アラニン付加に必須な酵素)について,その結晶構造が解明されており,GOATも同様な立体構造を有していると考えられる13).
このGOATはどのように発見されたのだろうか.我々は当初,グレリンに脂肪酸を修飾する酵素を組織から精製することを目指して研究を進めた.胃のタンパク質抽出物をクロマトグラフィーで展開し,それぞれのフラクションを脂肪酸修飾のないグレリンペプチドと,オクタン酸(CoAつき)とで反応させ,生じてきたオクタン酸グレリンをELISAで測定するアッセイ系だ.残念ながら,この方法ではうまくいかなかった.うまくいかなかった最大の理由は,GOATは膜結合型の酵素であり,酵素活性を保ったまま抽出してくる条件設定が難しかったことによる.
次に我々が試みたのは,データベースから脂肪酸転移酵素をピックアップし,培養細胞に発現させて活性をみる方法であった.当時,アミノ酸配列から脂肪酸転移酵素と推測される酵素は40種類くらいあった.それぞれをプラスミドの発現ベクターに組み込み,グレリン前駆体をコードする発現ベクターと同時に培養細胞にトランスフェクションし,培地中に分泌されてくるグレリンが脂肪酸で修飾されているのかどうかを調べるという方法だ.培地には修飾脂肪酸を供給するためオクタン酸を添加した.この方法がうまくいくことはGOATが発見されたあとの実験で確認されたが,残念ながら我々はこの方法で目的のグレリン脂肪酸転移酵素を見つけることができなかった.その理由は,目的のグレリン脂肪酸転移酵素をコードする遺伝子は,我々がデータベースを検索したときには,まだデータベースに含まれていなかったことにあった.我々はデータベースで未知の脂肪酸転移酵素を検索して約40種類のクローンをピックアップしたが,その3か月ほどあとに,目的のグレリン脂肪酸転移酵素のクローンがデータベースに登録されたのだ.当時の遺伝子データベースは,まだ不完全なものであったので,定期的にデータベースのチェックを行わなかったことが悔やまれる.
結局,グレリン脂肪酸転移酵素を発見したのはテキサス大学のノーベル賞受賞者,BrownとGoldsteinのグループだった14).グレリン研究に関してはまったくノーマークの研究チームであったが,Cellの発表論文を見たときには,その内容の完璧さに負けたと思った.彼らの探索方法は我々と同じ,データベースと培養細胞系を使ったものであった.
GOATの同定は先を越されたが,その酵素学的な性質については,まだ何もわかっていなかった.そこで我々はGOATタンパク質を培養細胞に発現させて,酵素反応を解析した15).すると驚いたことに,GOATの基質親和性は,グレリン修飾脂肪酸のメインである炭素数8個のオクタン酸よりも,炭素数6個のヘキサン酸に高い親和性を示した.これは意外な結果であったが,我々は別の研究で,脂肪酸の経口摂取後に胃内のグレリンの分子フォームの変化を調べたところ,オクタン酸摂取よりもヘキサン酸の摂取時の方が,速やかにヘキサン酸グレリン合成が増えたことを観察していた16).そのため,GOATの基質親和性がオクタン酸よりもヘキサン酸に高いことは十分に納得できた.
では,なぜ生体内ではオクタン酸グレリンがメインフォームで,ヘキサン酸グレリンではないのだろうか? おそらくは生体内で合成される中鎖脂肪酸では,オクタン酸の存在量がヘキサン酸よりも多いことが理由ではないかと考えている.
さて,グレリン脂肪酸修飾酵素が同定され,脂肪酸修飾の酵素反応についてもある程度は理解できた.このあと,グレリンに残された基礎的な研究課題はなんなのだろうか? それはもちろん,なぜグレリン受容体を活性化するには脂肪酸修飾のグレリンが必要なのかという問題だ.それを解明するにはグレリンが結合したグレリン受容体の立体構造を解明する必要がある.しかしGPCRの立体構造を解明することは,2010年ごろには技術的に非常にハードルが高かったため,自分たちでやるには無理だと思っていた.
転機になったのは,内藤記念財団のサバティカル研究助成によってカリフォルニア大学アーバイン校に数か月滞在したときだった.滞在中に,帰国してこの先どのような研究を行っていくのかを考えていたとき,最新のNatureの記事「Cell signalling:It’s all about the structure」が目にとまった17).そこにはβアドレナリン受容体の結晶構造を解明して,GPCRの結晶構造解析に革命を起こしたBrian Kobilka博士の苦労話が書かれてあった.Kobilka博士は2人の子どもと医学部生の奥さんがおり,多額の住宅ローンを抱えていた.そのため生活費を稼ぐために,週末には救急外来の医師を兼業していたらしい.さらにハワード・ヒューズ医学研究所からの資金援助が2003年に打ち切られ,研究室は財政難に陥り「大赤字」になってしまった.ところがKobilka博士は「あきらめようと思ったことは一度もない」と困難な研究に立ち向かった.「Kobilkaは精製用のカラムを持ったまま授業や会議から研究室に走って戻ってくる」と冗談で言われるくらいに研究にのめり込んでいた.GPCRの構造解析の先駆者であるKobilka博士は,この記事の翌年の2012年にノーベル化学賞を受賞した.
たとえどんなに困難な目標でも,自分のやりたいテーマに突き進むKobilka博士の姿勢をみて「そうだよな,これこそ研究者だよな」と感動した.そしてこの先,自分が本当になにをやりたいのかというと,それはグレリンの脂肪酸修飾基がなぜグレリン受容体の活性化に必要なのかを,グレリン受容体の立体構造から明らかにすることだった.自分はもちろんタンパク質の結晶構造解析などやったことはない,でもやりたい,やってみたい.
そこでアーバインに滞在中,GPCRの結晶構造解析の論文をたくさん読んで,自分たちにできるかどうかの可能性を検討した.その結果,自分には膜タンパク質(αアミド化酵素)の精製の経験があり,結晶化するためのグレリン受容体の構造変異や精製などは,なんとかできるのではないかと思った.まずグレリン受容体の結晶を作るところまでやって,その先はそのときに考えようと決心した.
10. アンタゴニスト結合型のグレリン受容体の構造解明
帰国してから,グレリン受容体の結晶構造解明を目指して,まずは安定して結晶化できるように受容体を変異させることから始めた.GPCRは一般にICL3(細胞内第3ループ)部分が不安定なので,この部分を定法どおり安定なT4リゾチームに置き換えた.また受容体タンパク質を大量に得るために,昆虫細胞の培養系の立ち上げも開始した.
順調にスタートしたのだが,やはり専門家の助けがほしい.そんなとき,神戸の学会で京都大学医化学の岩田研にいた清水(小林)拓也先生(現・関西医科大学)と一緒のセッションになり,これ幸いと食事会のときに共同研究を申し込んだ.岩田研は当時,プロスタグランジン受容体の結晶構造解明に取り組んでおり,国内で唯一のGPCRの立体構造解析を行っていた研究室だった.できれば京大に人を派遣して,専門家のもとで研究を進めたい.そんなときに当時大学院生だった椎村くんが,京大への派遣を引き受けてくれて,グレリン受容体の立体構造解明の研究は本格的にスタートした.
Kobilka博士たちの先駆的な研究によって,GPCRの結晶化へのストラテジーはほぼ確立されており,意外に簡単に結晶化までいくのではと期待していた.しかし実際にやってみると,変異体の作製とその発現のチェック,発現した受容体タンパク質の精製と安定性のチェック,そして結晶化のチェックなど,条件検討がかなり多いことがわかった.まあ,グレリン受容体の結晶化なんて他の研究グループはやらないだろうからと,焦ることもなく少しずつ研究は進んでいった.
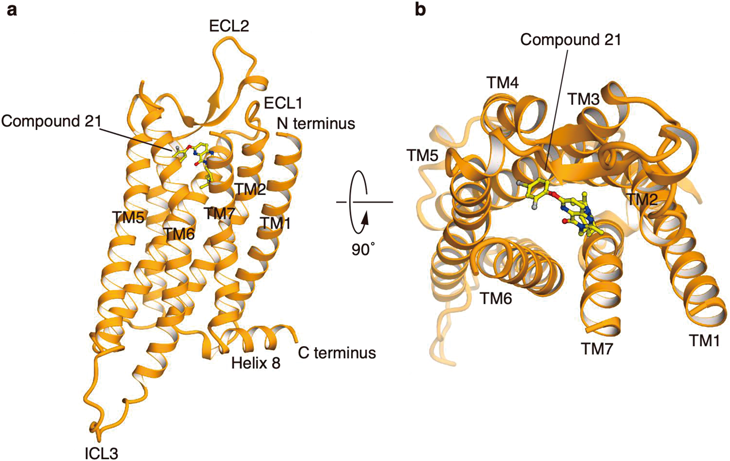
グレリンが結合した活性型受容体はハードルが高すぎるので,まずはアンタゴニストが結合した不活性型のグレリン受容体の結晶化だ.グレリン受容体は熱安定性が低いため,構造を安定化させることが必要だ.そのために,N末端とC末端の受容体活性に必要のない部分を削り,共結晶タンパク質としてのbRIL(大腸菌アポ型シトクロムb562RIL)をN末端に結合させた(先に行ったICL3のT4リゾチーム置換はうまくいかなかった).その上で,受容体の立体構造認識モノクローナル抗体,強力なアンタゴニストの使用(Compound 21)などによって結晶を安定化させる計画で進めた.
グレリン受容体の結晶化にあたって一番難しかったのは,受容体の発現量を多くすることと,安定性を高めることだった.グレリン受容体は培養細胞での発現量が低かったのだ.受容体タンパク質の発現量に関しては,T130Kの変異を入れることで発現量が劇的に増加した.これは定法ではT130Rの変異なのだが,椎村くんが次いでにとT130Kを作ったところ,この変異体の発現量が多かったのだ.何ごともやってみないとわからないものだ.
安定性については,グレリン受容体の立体構造認識のモノクローナル抗体を作製して,これと共結晶を作らせることでクリアすることができた.
アンタゴニストに関しては市販のいくつかのアンタゴニストを試したが,いま一つだった.そこで論文を探してみると,Compound 21という化合物のIC50がこれまでのアンタゴニストで最も低い(つまり受容体への結合能が高い)ことがわかった18).Compound 21は市販されていないし,我々には低分子化合物の合成などできない.仕方なく,かなりの研究費を費やして,外部の会社に合成を委託した.その金額は,自分たちのような小規模な研究室にとって,目の玉が飛び出るくらいの金額だった.でもそれ以外に方法はない.うまくいかなかったら大金をどぶに捨てるようなものだったが,結果として,このCompound 21を使ったことが成功に結びついた.(付け加えると,のちにアンタゴニストの結合実験が必要となり,放射線ラベル用の追加の合成と,放射線ラベル化のために,さらに多額の研究費が必要となり,ラボは一時破産しかけた.)
このような工夫によって,結晶化のためのグレリン受容体タンパク質が精製され,まずは試しにと抗体およびアンタゴニストとともに結晶化のスクリーニングを行った.すると結晶らしきものができた(図8).期待もせずにSPring-8で放射光解析を行うと,何とそれはまぎれもなくグレリン受容体の結晶であり,たった1回の試行でグレリン受容体の結晶構造が解けてしまった(図9).ここまで5年くらいの年月を費やしたが,最終段階はほんの数日だった.
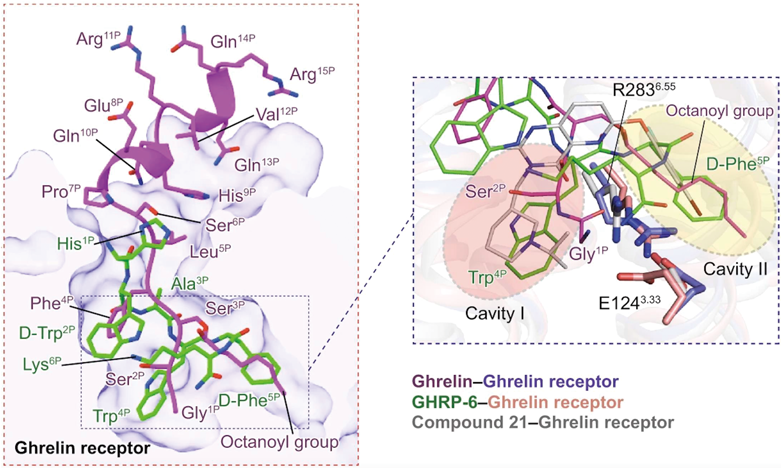
解明されたグレリン受容体の立体構造には二つの大きな特徴があった19).一つはリガンド結合ポケットが二股構造になっていることで,E1243.33とR2836.55の間のイオン結合によって,ポケットが二つの領域に分かれていた.我々はこの領域をCavity IとCavity IIとした.結晶構造から明らかになったアンタゴニストのCompound 21の配位は,この二股構造を挟み込んで固定しているものであった.このCompound 21のリガンド結合ポケットへの配位の仕方が,Compound 21が強力な阻害作用を示す理由なのだろうと推測された.
もう一つの特徴は,膜貫通領域のTM6とTM7の間に大きなギャップ結合があり,しかもこのギャップの周辺にはフェニルアラニンが多く配置していることである(5個のフェニルアラニン).我々はこのギャップ構造をクレバスと名づけた.この五つのフェニルアラニンのうち,F312Aの変異を除いて,フェニルアラニンをアラニンに変異させるとグレリン結合能はほとんどなくなる.したがって,このフェニルアラニンのクラスターはグレリン認識に必須である.またフェニルアラニンは疎水性が強いアミノ酸であることから,我々はこのフェニルアラニンのクラスターにグレリンの疎水性の強いオクタン酸部分が配位して,グレリン受容体を活性状態にするのではないかと予想した.
11. 活性型グレリン受容体の構造解明でまたしても敗北
以上の不活性型グレリン受容体から推測されることはあくまでも推測にすぎず,グレリンの脂肪酸修飾基とグレリン受容体との相互作用を解明するには,グレリンそのものとグレリン受容体が結合した状態の3D構造を解明する必要がある.そのため,次にはグレリンが結合したグレリン受容体の3D構造をクライオ電子顕微鏡によって解析する計画を進めた.研究方法の進歩は速く(速すぎる!),GPCRの立体構造解明は,結晶解析からクライオ電顕にあっという間にシフトしていたのだ.
しかし,我々の計画はあっさりと先を越されてしまった.我々がグレリン受容体のアンタゴニスト結合型の構造を発表して,その翌年(2021年)の8月から翌年1月の間に三つのグループから次々にグレリンが結合した活性型の構造が解明された20–22)(図10).一つのグループの論文は私が査読したものであるし,もう一つの論文はbioRxivに公開されていたので,論文出版前から内容は知っていた.グレリン受容体に関しては自分たちしかやっていないと思っていたが,そんなことはなかった.アンタゴニスト結合の不活性型の構造を他の研究グループよりも速く発表できたことは,あとになってみるととてもラッキーだった.多数のクライオ電顕を保持している中国の研究グループにはクライオ電顕を使った研究では,まったく歯が立たないからだ.
他の研究グループに先を越されたのは仕方がないが,これでグレリンが結合した活性型のグレリン受容体の構造が明らかになり,脂肪酸の役割も詳しく解明された.
グレリンのN末端グリシンから7番目のプロリンまでの部分はリガンド結合部位の大部分を占めている.8番目のグルタミン酸から15番目のアルギニンの部分は極性やチャージの多い部分で,αヘリックスを形成して,リガンド結合部位の上に位置している.
問題は3番目のセリン残基に結合しているオクタン酸の場所だ.クライオ電顕のデータからは,オクタン酸はセリン残基からTM4とTM5のギャップ部分に向かって水平に伸びていて,リガンド結合ポケットのCavity IIを占めていることがわかった.F2866.58が3番目セリンの側鎖の部分を覆っており,脂肪酸はI1784.60とL1814.63と疎水結合を形成している.
我々は,不活性型グレリン受容体の構造から,グレリンのペプチド部分はCavity IIに配位して,脂肪酸はCavitiy IからフェニルアラニンクラスターのあるTM6とTM7の間を突き抜けるのではないかと考えていた.しかし,実際にはペプチド部分はCavity Iに,脂肪酸部分はCavity IIに配位しており,予想とは逆だった.何ごともやってみないとわからないものだ.
我々が解明したアンタゴニストが結合した不活性型のグレリン受容体の構造から,リガンド結合ポケットがE1243.33とR2836.55の間のイオン結合によって二つの領域(Cavity IとCavity II)に分けられていることはわかっていた.グレリンがリガンド結合ポケットに入ると,ペプチドのN末端部分はCavity Iに,オクタン酸部分はCavity IIに固定され,R2836.55の側鎖を受容体の膜貫通ヘリックスの中心部分から引き離す.そしてGPCRの活性化に共通なTM6の外側への回転を誘導して,受容体を活性型のポジションに変化させる.これがグレリン受容体の活性化メカニズムである.
グレリンが結合した活性型グレリン受容体の構造を,自分たちで解明できなかったことはとても残念だった.しかし,他の研究グループに先を越されることは,いつでも起こりうることなので,仕方がないことだ.これでグレリンに関する基礎研究の大きなテーマはすべて終了した.
グレリンはその摂食亢進作用から,食欲不振に対しての臨床応用が期待された23, 24).食欲不振を症状とする代表的な疾患には,神経性食欲不振症(いわゆる拒食症)があり,また慢性疾患,抗がん剤治療,高齢者などでも食欲不振が大きな問題となる.
神経性食欲不振症に対してのグレリン投与の効果については,某製薬企業が臨床試験を行った.しかし,臨床治験はまったくうまくいかなかった.データはばらばらで,グレリンを投与した患者が逆に摂食量が減るなど,この疾患の難しさをあらためて認識した.
一方で,有効な治療法のないがん悪液質に対しての治験が行われた.悪液質を示す疾患は,がん,AIDS,慢性心不全,慢性閉塞性肺疾患(COPD)などがある.特にがん患者では悪液質の発現頻度が高く,最終的には,がん患者の90%近くが悪液質となり,がん患者の死因の約20%を占めるといわれている.
がん悪液質に対する治療目標は,がん患者さんの食欲を増進し,骨格筋や臓器組織から構成される除脂肪体重の減少阻止である.これまではがん悪液質に対しての有効な治療薬はなかったが,グレリンはその作用から有望な候補であった.
治験に使われたのはグレリンそのものではなく,グレリン受容体に作用する,いわゆるGHSである.グレリンそのものならばペプチドであるため注射によって投与する必要性があるが,低分子化合物性のGHSならば経口投与可能なので,これは当然のことであった.GHSのうちアナモレリンが使われた.スイスのヘルシン社と小野薬品が開発を進めた25).薬事・食品衛生審議会では,2019年8月の最初の申請時では承認に至らず,継続審議となり,その後,データを追加して2020年12月の審議会で承認され,2021年1月に正式承認,同年4月に販売開始となった.
このグレリン様作用薬は「エドルミズ」という製品名で,「悪性腫瘍(非小細胞肺がん,胃がん,膵がん,大腸がん)におけるがん悪液質」に対する治療薬である.
グレリンの発見から,治療薬への応用まで22年という長い年月がかかったが,グレリン(正確にいえばグレリン様化合物)が治療法の乏しかったがん悪液質の治療薬となったことに,グレリン発見者の一人としてこれほど嬉しいことはない.
「医者として救える患者さんの数は限られているが,基礎研究によって薬が開発されれば,もっともっと多くの患者さんを救うことができる」と,学生時代に青くさい情熱をもって基礎研究の世界に入ったが,まさか本当に自分たちの研究成果から薬が生まれるとは思ってもみなかった.
グレリンの研究は私の研究人生そのものである.その発見から,機能解析,グレリン受容体の構造解析など,ときにはライバルグループに先を越されて悔しい思いもしたが,グレリン研究を続けることができて本当によかった.グレリンの発見はとても幸運に恵まれたからだと思う.他のグループが先に発見してもおかしくはなかった.さらにラッキーなことに,グレリンには活性に必須な脂肪酸修飾があったことだ.その構造解明には苦労したが,それでも3か月くらいで解明できた.こんな想像もできないようなユニークな構造なんだから,きっとNatureにアクセプトされるだろうと思った.事実,レビュアーの評価はよかった.また生理作用の面でも,その時期にブームだった摂食調節に重要なホルモンだったために,世界中の大勢の研究者がグレリンの研究を行った.その結果,グレリンの発見論文の被引用回数は2022年10月の段階で7,143回を超え,PubMedで「ghrelin」で検索すると12,044編の論文が表示される.ありがたいことである.
わたしは医学部の学生時代に『レーニンジャー生化学』の教科書を原書で読み,生化学に興味を持って研究者を志した.その『レーニンジャー生化学』に今では「グレリン」についての記載項目があることは,とてもうれしく光栄なことである.
研究人生にこれ以上のものを望むのは欲張りすぎだろう.同世代のすばらしい研究者と比べて,それほど優秀ではない自分の研究人生としては上出来だと思っている.これから先のグレリン研究がどのように展開していくのか,期待してこの総説を終えたいと思う.
謝辞Acknowledgments
ここに書いたグレリンの研究は,国立循環器病センター研究所生化学部(現在の国立循環器病研究センター研究所では生化学部は廃部になっている.時代の流れか?)をはじめ,久留米大学,宮崎大学,京都大学,そしてそれ以外の多くの研究機関で行われたものです.一緒に研究を行ってくれた大勢の研究者のみなさんに感謝いたします.
引用文献References
1) Davis, J.C. (1954) The relation between the pancreatic alpha cells and certain cells in the gastric mucosa. J. Pathol. Bacteriol., 67, 237–240.
2) Bowers, C.Y., Momany, F., Reynolds, G.A., Chang, D., Hong, A., & Chang, K. (1980) Structure–activity relationships of a synthetic pentapeptide that specifically releases growth hormone in vitro. Endocrinology, 106, 663–667.
3) Smith, R.G., Cheng, K., Schoen, W.R., Pong, S.S., Hickey, G., Jacks, T., Butler, B., Chan, W.W.S., Chaung, L.Y.P., Judith, F., et al. (1993) A nonpeptidyl growth hormone secretagogue. Science, 260, 1640–1643.
4) Cheng, R., Chan, W.W.S., Barreto, A. Jr., Convey, E.M., & Smith, R.G. (1989) The synergistic effects of His-D-Trp-Ala-Trp-D-Phe-Lys-NH2 on growth hormone (GH)-releasing factor-stimulated GH release and intracellular adenosine 3′,5′-monophosphate accumulation in rat primary pituitary cell culture. Endocrinology, 124, 2791–2798.
5) Howard, A.D., Feighner, S.D., Cully, D.F., Arena, J.P., Liberator, P.A., Rosenblum, C.I., Hamelin, M., Hreniuk, D.L., Palyha, O.C., Anderson, J., et al. (1996) A receptor in pituitary and hypothalamus that functions in growth hormone release. Science, 273, 974–977.
6) Garbers, D.L., Chrisman, T.D., Wiegn, P., Katafuchi, T., Albanesi, J.P., Bielinski, V., Barylko, B., Redfield, M.M., & Burnett, J.C. Jr. (2006) Membrane guanylyl cyclase receptors: an update. Trends Endocrinol. Metab., 17, 251–258.
7) Reinscheid, R.K., Nothacker, H.P., Bourson, A., Ardati, A., Henningsen, R.A., Bunzow, J.R., Grandy, D.K., Langen, H., Monsma, F.J. Jr., & Civelli, O. (1995) Orphanin FQ: A neuropeptide that activates an opioidlike G protein-coupled receptor. Science, 270, 792–794.
8) Hinuma, S., Habata, Y., Fujii, R., Kawamata, Y., Hosoya, M., Fukusumi, S., Kitada, C., Masuo, Y., Asano, T., Matsumoto, H., et al. (1998) A prolactin-releasing peptide in the brain. Nature, 393, 272–276.
9) Sakurai, T., Amemiya, A., Ishii, M., Matsuzaki, I., Chemelli, R.M., Tanaka, H., Williams, S.C., Richardson, J.A., Kozlowski, G.P., Wilson, S., et al. (1998) Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior. Cell, 92, 573–585.
10) McKee, K.K., Tan, C.P., Palyha, O.C., Liu, J., Hreniuk, D.L., Smith, R.G., Howard, A.D., & van der Ploeg, L.H.T. (1997) Cloning and characterization of two human G protein-coupled receptor genes (GPR38 and GPR39) related to the growth hormone secretagogue and neurotensin receptors. Genomics, 46, 426–434.
11) Kojima, M., Hosoda, H., Date, Y., Nakazato, M., Matsuo, H., & Kangawa, K. (1999) Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature, 402, 656–660.
12) Taylor, M.S., Ruch, T.R., Hsiao, P.Y., Hwang, Y., Zhang, P., Dai, L., Huang, C.R.L., Berndsen, C.E., Kim, M.S., Pandey, A., et al. (2013) Architectural organization of the metabolic regulatory enzyme ghrelin O-acyltransferase. J. Biol. Chem., 288, 32211–32228.
13) Ma, D., Wang, Z., Merrikh, C.N., Lang, K.S., Lu, P., Li, X., Merrikh, H., Rao, Z., & Xu, W. (2018) Crystal structure of a membrane-bound O-acyltransferase. Nature, 562, 286–290.
14) Yang, J., Brown, M.S., Liang, G., Grishin, N., & Goldstein, J.L. (2008) Identification of the acyltransferase that octanoylates ghrelin, an appetite-stimulating peptide hormone. Cell, 132, 387–396.
15) Ohgusu, H., Shirouzu, K., Nakamura, Y., Nakashima, Y., Ida, T., Sato, T., & Kojima, M. (2009) Ghrelin O-acyltransferase (GOAT) has a preference for n-hexanoyl-CoA over n-octanoyl-CoA as an acyl donor. Biochem. Biophys. Res. Commun., 386, 153–158.
16) Nishi, Y., Hiejima, H., Hosoda, H., Kaiya, H., Mori, K., Fukue, Y., Yanase, T., Nawata, H., Kangawa, K., & Kojima, M. (2005) Ingested medium-chain fatty acids are directly utilized for the acyl modification of ghrelin. Endocrinology, 146, 2255–2264.
17) Buchen, L. (2011) Cell signalling: It’s all about the structure. Nature, 476, 387–390.
18) Ye, Z., Gao, Y., Bakshi, R.K., Chen, M.H., Rohrer, S.P., Feighner, S.D., Pong, S.S., Howard, A.D., Blake, A., Birzin, E.T., et al. (2000) Modeling directed design and biological evaluation of quinazolinones as non-peptidic growth hormone secretagogues. Bioorg. Med. Chem. Lett., 10, 5–8.
19) Shiimura, Y., Horita, S., Hamamoto, A., Asada, H., Hirata, K., Tanaka, M., Mori, K., Uemura, T., Kobayashi, T., Iwata, S., et al. (2020) Structure of an antagonist-bound ghrelin receptor reveals possible ghrelin recognition mode. Nat. Commun., 11, 4160.
20) Qin, J., Cai, Y., Xu, Z., Ming, Q., Ji, S.Y., Wu, C., Zhang, H., Mao, C., Shen, D.D., Hirata, K., et al. (2022) Molecular mechanism of agonism and inverse agonism in ghrelin receptor. Nat. Commun., 13, 300.
21) Liu, H., Sun, D., Myasnikov, A., Damian, M., Baneres, J.L., Sun, J., & Zhang, C. (2021) Structural basis of human ghrelin receptor signaling by ghrelin and the synthetic agonist ibutamoren. Nat. Commun., 12, 6410.
22) Wang, Y., Guo, S., Zhuang, Y., Yun, Y., Xu, P., He, X., Guo, J., Yin, W., Xu, H.E., Xie, X., et al. (2021) Molecular recognition of an acyl-peptide hormone and activation of ghrelin receptor. Nat. Commun., 12, 5064.
23) Nakazato, M., Murakami, N., Date, Y., Kojima, M., Matsuo, H., Kangawa, K., & Matsukura, S. (2001) A role for ghrelin in the central regulation of feeding. Nature, 409, 194–198.
24) Tschöp, M., Smiley, D.L., & Heiman, M.L. (2000) Ghrelin induces adiposity in rodents. Nature, 407, 908–913.
25) Garcia, J.M., Friend, J., & Allen, S. (2013) Therapeutic potential of anamorelin, a novel, oral ghrelin mimetic, in patients with cancer-related cachexia: a multicenter, randomized, double-blind, crossover, pilot study. Support. Care Cancer, 21, 129–137.
著者紹介Author Profile
 児島 将康(こじま まさやす)
児島 将康(こじま まさやす)久留米大学分子生命科学研究所遺伝情報研究部門 教授.医学博士.
略歴1984年宮崎医科大学医学部卒業,88年同大学院博士課程修了.日本学術振興会特別研究員や国立循環器病センター研究所生化学部室員および室長を経て,2001年4月より現職.
研究テーマと抱負グレリンの研究と,未知のペプチドホルモン探索研究.
趣味山登り,クラシック音楽,読書,映画.