1)TAタンパク質の配列的特性とオルガネラ局在化
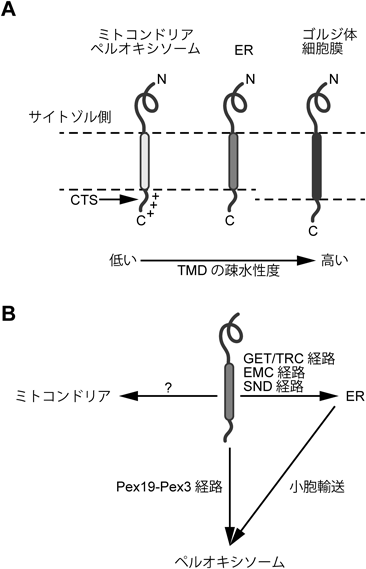
C末端に膜貫通配列(TMD)を一つ持つ膜タンパク質はTAタンパク質と呼ばれる.出芽酵母では55個,ヒトでは325個のTAタンパク質をコードする遺伝子が見つかり,全膜タンパク質の3~5%を占める5, 6).TAタンパク質は,オルガネラ膜融合,タンパク質輸送,品質管理,オートファジー,アポトーシスなど多彩な生命機能に関わる7–10).TAタンパク質は,ER,ミトコンドリアそしてペルオキシソームに配送され,N末端領域をサイトゾルに向けたトポロジーでそれぞれの膜に組み込まれる(図1A)7–10).TAタンパク質の局在化シグナルは,TMDとそのC末端配列(C-terminal sequence:CTS)にある(図1A).TAタンパク質の局在化シグナルはリボソームでの合成が完了するまでサイトゾルに露出しないため,SRPなどのリボソーム結合性の標的化因子が認識できず,TAタンパク質は翻訳が完了した後に目的のオルガネラへ配送される7–10).ミトコンドリアとペルオキシソームに配送されるTAタンパク質のTMDの疎水性はERに配送されるTAタンパク質のTMDと比べ低く,CTSは正電荷を持つものが多い(図1A)7, 8).さらに,ゴルジ体や細胞膜に局在するTAタンパク質のTMDは,ERに局在化するTAタンパク質よりも長く,疎水性が高い傾向がある(図1A)7, 8).しかしながら,TAタンパク質の局在をTMDの疎水性度とCTSの電荷という二つの要素だけで正確に予測することは難しい.最近のバイオインフォマティクス解析の結果から,ERに局在する疎水性の比較的低いTAタンパク質はTMDのαヘリックスやhelical wheel plotで予測された疎水性面の度合いを調べることで,精度高く予測できることが示され,少なくとも酵母細胞を用いた局在化解析によって,この予測結果が支持された11).
TAタンパク質の中には二つ以上のオルガネラに局在し,その多重性が細胞機能に重要な場合がある.たとえば,哺乳動物におけるFis1(mitochondrial fission 1),Mff(mitochondrial fission factor)そしてMiro1(mitochondrial Rho GTPase-1)は,ミトコンドリアとペルオキシソームの両方に局在するTAタンパク質であり,オルガネラの分裂や移動に関わることが知られている12–14).
2)TAタンパク質の配送経路
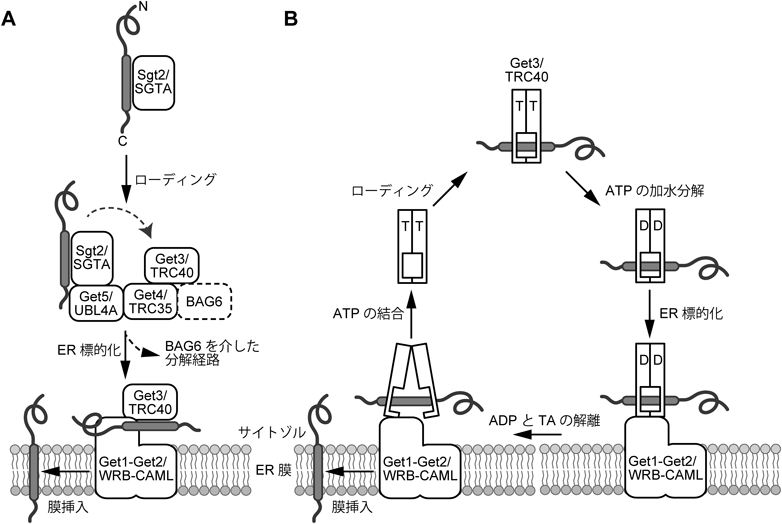
ERへ配送されるTAタンパク質は,出芽酵母ではGET(guided entry of tail-anchored)経路15),哺乳動物ではTRC(transmembrane domain recognition complex)経路16)と呼ばれる進化的に保存された経路を介して,ERに標的化され,ER膜に組み込まれる(図1B,図2A).GET/TRC経路は,ウサギ網状赤血球ライセート(rabbit reticulocyte lysate:RRL)由来の無細胞翻訳系を用いて合成されたER局在のTAタンパク質Sec61βの結合因子としてTRC40が同定されたことで発見された16).その後,出芽酵母のTRC40ホモログとしてGET3遺伝子が見つかり,さらにGET3と遺伝学的相互作用を示す遺伝子としてGET1, GET2が発見された15).その後の解析により,GET/TRC経路の全体像が明らにされた(図2A)17).新規合成されたTAタンパク質は,Sgt2(small glutamine-rich tetratricopeptide repeat-containing protein 2,酵母)/SGTA(small glutamine-rich tetratricopeptide repeat-containing protein α,哺乳動物)と結合し,プレローディング複合体であるGet4-Get5(酵母)/TRC35-UBL4A(ubiquitin like 4A)-BAG6(BAG cochaperone 6)(哺乳動物)を介してGet3/TRC40に受け渡される.Get3/TRC40は,ホモ二量体のATPアーゼであり,ATP結合型のGet3/TRC40はTAタンパク質のTMDと結合し,ローディングする(図2B).Get3/TRC40はTAタンパク質をローディングすると,ADP結合型になり,プレローディング複合体から解離する(図2B).その後,Get3/TRC40はER膜受容体であるGet1-Get2複合体(酵母)/WRB(tryptophan-rich basis protein)-CAML(calcium-modulating cyclophilin ligand)複合体(哺乳動物)と結合すると,ADPとTAタンパク質を解離し,TAタンパク質の膜挿入を促す(図2B).Get3/TRC40に再びATPが結合することで,TAタンパク質のER標的化とER膜挿入のサイクルが回る(図2B).このサイクルは出芽酵母と哺乳動物の間で共通の機構であるが,TRC経路ではBAG6が,N末端のUBLドメインを介して,ユビキチンリガーゼRNF126(ring finger protein 126)をリクルートすることで,ER膜の標的化に失敗したTAタンパク質をユビキチン化する(図2A)18, 19).SGTAと結合したTAタンパク質は,TRC40に速やかに受け渡されれば,ERに標的化できるが,SGTAからの解離が遅い場合にはBAG6に受け渡され,ユビキチン化経路へ回る20).
TAタンパク質のER標的化経路には,GET/TRC経路以外にも,EMC(ER membrane complex)を介した経路が存在する(図1B).酵母EMC遺伝子は,ERストレス感受性を指標した遺伝学的スクリーニングによって発見され,ER膜上に8個の非相同なタンパク質から構成されるタンパク質複合体を作ることが明らかになったが,EMCの機能については不明であった21).ヒトにおいてもEMC遺伝子のホモログが見つかり,これまでにヒトでは9個の非相同なEmcタンパク質から構成されていることが明らかになった22).そして,ヒト由来の精製EMCをリポソームに再構成することによって,EMCがTAタンパク質の膜挿入を促進するインサルターゼであることが示された22).クライオ電子顕微鏡(electron microscopy:EM)による構造解析の結果から,Get1/WRBとEMCの膜貫通サブユニットEmc3には,インサルターゼ活性を持つYidC(細菌)/Oxa1(cytochrome oxidase activity 1,ミトコンドリア)/Alb3(albino3,葉緑体)ファミリータンパク質と高い構造類似性を示すという共通の特徴が見つかった23–25).また,疎水性の高いTMDを持つTAタンパク質は,GET/TRC経路を利用し,EMC経路は疎水性の低いTMDを持つTAタンパク質を好む傾向がある22).これは,Get3が疎水性の高いTMDを持つTAタンパク質と強く結合するのに対して,EMC経路の標的化因子であるカルモジュリンは疎水性の低いTMDを持つTAタンパク質と高い親和性を持つからである22).しかし,ヒトや酵母の細胞レベルの解析では,GET/TRC経路,EMC経路のどちらかを欠損しても生育は可能なことから,TAタンパク質はこれらの経路を厳密に使い分けているのではなく,部分的に補完できる関係にあると考えられる.
酵母遺伝学的スクリーニングによって,SND(SRP-independent targeting)経路が発見された(図1B)26).SND経路は,Snd1, Snd2そしてSnd3から構成され,Snd1はサイトゾル局在のリボソーム結合性タンパク質であり,Snd2およびSnd3はSec61チャネルと相互作用するER局在の膜タンパク質である.SND経路の欠損酵母株は目立った表現型を示さないが,SRP経路もしくはGET経路の二重変異により酵母が致死性を示すことから,SRP経路およびGET経路のバックアップ経路として機能すると考えられる26).哺乳動物においても,SND遺伝子のホモログは存在するが,SND経路を介したTAタンパク質のER標的化の分子機構については不明な点が多い27).
Pex15(peroxisome related 15,酵母)/PEX26(哺乳動物)は,ペルオキシソームに局在するTAタンパク質である28, 29).新規合成された出芽酵母のPex15は標的化因子Pex19と結合し,ペルオキシソーム膜の受容体Pex3を介して直接ペルオキシソームに配送されるPex19-Pex3経路30),もしくはGET経路を介してER膜に標的化し,小胞輸送を介してERからペルオキシソームに移行する経路を使う(図1B)15).哺乳細胞のPEX26はTRC経路には依存せず,PEX19-PEX3経路を介してペルオキシソームに直接配送される31).
これまでに,酵母遺伝学的スクリーニングによって,ミトコンドリアTAタンパク質の局在化に影響を与える遺伝子が探索されたが,ミトコンドリア外膜に配送されるTAタンパク質にはGet3/TRC40, Pex19のような標的化因子が見いだされなかった32).ミトコンドリアの外膜はエルゴステロール(コレステロールの一種)含量が他のオルガネラ膜と比べ低いためにTAタンパク質の自発的な膜挿入が起こりやすく,ミトコンドリアのTAタンパク質は標的化因子非依存的に標的化,膜挿入できると考えられてきた33).一方で,Itakuraらは,RRL由来の無細胞翻訳系を用いてミトコンドリアTAタンパク質Omp25(mitochondrial outer membrane protein 25)の結合因子としてUBQLNを発見した34).UBQLNは,UBA-UBLドメインを持つタンパク質ファミリー(UBQLN1~4)であり,UBQLN2は筋萎縮性側索硬化症の原因遺伝子として報告されている35).UBQLNは,疎水性のメチオニンがリッチなSTI(stress inducible proteins or Hsp70–Hsp90 organizing protein)ドメインを介してOmp25のTMDと結合し,サイトゾルでOmp25の凝集を防ぐ分子シャペロン機能を持つことでOmp25をミトコンドリアに取り込まれる状態に保つことが明らかにされた34).さらに,UBQLNはUBAドメイン,UBLドメインを介してユビキチンリガーゼとプロテアソームをそれぞれリクルートし,Omp25を分解に回す働きも持つことも示された34).
出芽酵母のミトコンドリア外膜上にはMIM(mitochondria import)複合体が存在し,TAタンパク質の膜挿入を促進することが報告されている36).しかし,真核生物においてMIM複合体の保存性は低く,哺乳動物にはMIM複合体のホモログは見つからず,哺乳動物におけるミトコンドリアTAタンパク質の膜挿入機構は長年不明であった.興味深いことに近年Gunaらは,哺乳動物細胞を用いたCRISPRi(CRISPR interference)スクリーニングによって,ミトコンドリアTAタンパク質の効率的な外膜挿入にはMTCH2(mitochondrial carrier homolog 2)が関与することを見いだした37).Gunaらは,精製したMTCH2をリポソームに組み込んだ再構成実験により,MTCH2がインサルターゼ活性を持つことを示した37).MTCH2はミトコンドリア外膜に局在する小分子輸送体SLC25ファミリータンパク質であり,MIM複合体やYidC/Oxa1/Alb3ファミリータンパク質と配列的,構造的特徴は大きく異なるが,AlphaFold2による予測構造からMTCH2のTMDには親水性の溝が見つかり,変異体解析により機能的重要性が示された37).
3. Msp1を介した誤配送TAタンパク質の配送校正機構
1) ミトコンドリア外膜に局在するAAA-ATPアーゼMsp1
TAタンパク質の過剰発現や標的化経路の変異によって,TAタンパク質は本来の目的地とは異なる目的地に配送(誤配送)されることがある.出芽酵母ではGET経路を欠損すると,ERやペルオキシソームに配送されるTAタンパク質のいくつがサイトゾルに凝集体を形成するか,もしくはミトコンドリアに誤配送されることが報告されていた15, 21).2014年にChenらおよびOkreglakらは独立に,Msp1(mitochondrial sorting of proteins 1)がミトコンドリア外膜に誤配送されたTAタンパク質の分解に関わる因子であることを報告した38, 39).Msp1はミトコンドリア外膜とペルオキシソームに二重局在するAAA(ATPases associated with diverse cellular activities)-ATPアーゼであり,酵母からヒト[ATAD1(ATPase family AAA domain containing 1)]まで高度に保存されている38–40).彼らは,msp1欠損酵母(msp1Δ)株の生育は野生型酵母と変わらないが,GET経路との二重遺伝子欠損酵母株は強い増殖阻害を生じ,ミトコンドリアの形態異常,呼吸活性の低下,ミトコンドリアDNAの消失が引き起こされることを見いだした38, 39).そして,GET経路が欠損すると,ペルオキシソームに局在するTAタンパク質Pex15やゴルジ体に局在するv-SNAREタンパク質Gos1(Golgi SNARE 1)が,ミトコンドリアに誤配送され,Msp1依存的にミトコンドリアから除去されることが明らかとなった38, 39).また,Okreglakらは,Pex15のペルオキシソーム局在化シグナルを欠失した変異体Pex15Δ30を作製し,これがMsp1のモデル基質になることも示した39).さらに,Chenらは,哺乳細胞を用いてミトコンドリアに誤配送されたPEX26, Gos28(Gos1のヒトホモログ)がATAD1によって除去されることを示した38).
MSP1は1993年に出芽酵母を用いた遺伝学的スクリーニングによって,ミトコンドリアタンパク質の仕分けに関わる因子としてNakaiらにより発見された遺伝子である40).Nakaiらは,ミトコンドリアのシトクロムbc1複合体の構成因子シトクロムc1のN末端ミトコンドリア移行シグナルをミトコンドリア外膜タンパク質Tom70のN末端TMDに置き換えることでシトクロムc1を外膜に人工的に局在させた改変体を作製し,これをシトクロムc1欠損株内に発現させた.シトクロムc1変異体発現酵母株は,グルコースを炭素源とする培地で生育可能であるが,グリセロールを炭素源とする培地では生育することができない.この表現型のマルチコピーサプレッサー遺伝子として見つかったのがMSP1であった.このスクリーニング結果は,MSP1過剰発現によって外膜にアンカーさせたシトクロムc1がミトコンドリア内膜に誤配送されることで,シトクロムc1の本来の機能を相補し,グリセロール培地で生育できるようになったことを示唆している40).こうした経緯で発見されたMSP1であったが,前述したようにmsp1Δ株は,目立った表現型を示さなかったために,20年以上その機能が不明のままとなっていた.
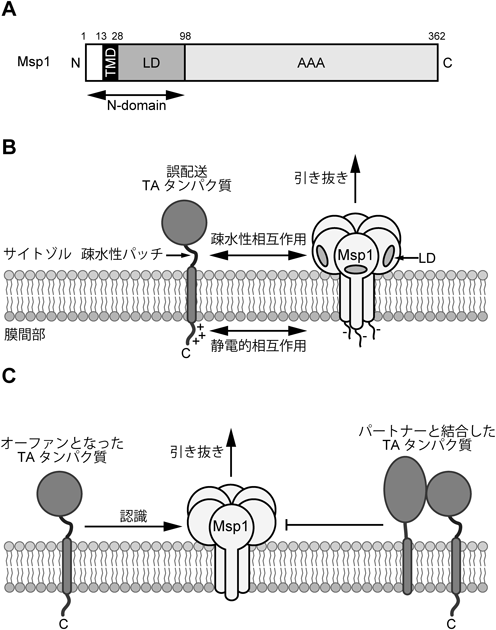
Msp1は,N末端に膜にアンカーするためのTMDとサイトゾル側にAAAドメインを持ち,酵母Msp1は全長362残基の膜タンパク質である(図3A)40).AAA-ATPアーゼは,一般的にホモ六量体のリング構造を作り,ATP依存的にリング中心の穴に基質を通すことで,タンパク質基質のアンフォールティングや複合体の脱会合,膜からの引き抜きなどさまざまな機能を発揮する41).Msp1は,Katanin, Spastin, Vps4(vacuolar protein sorting 4)そしてFidgetinといった,meiotic cladeと呼ばれるサブグループに分類されるAAA-ATPタンパク質である9).meiotic cladeに属するAAA-ATPアーゼは,基質結合に関わるN末端ドメインと一つのAAAドメインから構成され,Katanin, Spastin, Vps4はN末端のMIT(microtubule interacting and trafficking)ドメインを介して,微小管と結合し,ATP依存的に脱重合する9).ChenらおよびOkreglakらの報告では,Msp1がミトコンドリアに誤配送されたTAタンパク質の分解に関わることが明らかにされたが,Msp1の機能は既知のAAA-ATPアーゼとの類似性から,膜からの引き抜きと予想された38, 39).その後,Wohleverらによって,TMDを含めた全長の精製Msp1と人工的なTAタンパク質をリポソームに再構成した実験によって,Msp1のATP依存的な膜引き抜き活性が証明された42).そして,Msp1のTMDを六量体化する人工的なペプチド配列に置き換えることで,可溶性の六量体化Msp1が作製され,Msp1のATP依存的なアンフォールディグ活性が示された43).さらに,WangらがクライオEM解析による好熱性真菌Chaetomium thermophilum由来Msp1の構造を報告した44).この研究では,TMDを除いたMsp1の可溶性ドメインを使用し,六量体化を安定化するためにAAAドメイン内のwalker Bモチーフに変異を導入した試料と,ATP加水分解の遷移状態を模倣するADP-BeFが結合した試料が解析された.その結果,open formとclose formの2状態のMsp1構造が決定され,どちらも発現宿主である大腸菌から持ち込まれたペプチドが,基質を模倣するようにMsp1の六量体リング中央の穴に結合した複合体の構造であった.そして,Msp1の各サブユニットが右巻きのらせん階段状に集合し,基質ペプチドを中央のリングで取り囲む構造を作っていた.こうした結果から,Wangらは,Msp1が基質をサブユニット間で手渡しながら移行させることで膜から引き抜くモデル(hand-over-hand translocationモデル)を提唱した44).近年,Wangらによってヒト由来ATAD1のクライオEM構造が報告され,C. thermophilum Msp1と共通した構造的特徴が見つかり,同様のメカニズムで基質を引き抜くことが示された45).
2)Msp1による誤配送TAタンパク質の認識機構
前述のようにMsp1は,ミトコンドリアに誤配送されたTAタンパク質を基質とし,膜から引き抜くことが明らかとなったが,Msp1がどのようにして誤配送TAタンパク質を認識するのか,については不明であった.Liらは,Msp1のモデル基質Pex15Δ30を用いたin vivo光架橋実験により,Msp1がPex15Δ30のTMD近傍に位置する12アミノ酸残基の疎水性パッチと膜間部側の塩基性残基を認識することを示した.そして,Pex15Δ30の疎水性パッチをミトコンドリア内在性のTAタンパク質Fis1, Gem1のTMD近傍に挿入するとMsp1の基質になることも示された46).この結果から「2点認識モデル」が提唱された(図3B)46).しかしながら,Pex15Δ30の疎水性パッチのような配列は,Pex15Δ30以外の基質Gos1, Fmp32(found in mitochondrial proteome 32),Frt1(functionally related to TCP1),Ysy6には見つからず,十分に説明できるモデルではないと考えられる.このモデルに対し,Weirらは,Pex15がペルオキシソーム膜上でPex3と相互作用することを見いだし,これによりペルオキシソームに局在するMsp1からの認識を逃れることを示した47).すなわち,Pex15はペルオキシソーム膜上では結合パートナー(Pex3)が存在することで,Msp1による認識から逃れるが,ミトコンドリア外膜上ではPex3が存在しないため,Pex15は孤児(オーファン)となりMsp1の基質となることが示唆された.これを「オーファンモデル」と呼ぶ(図3C)47).また,FKBP(FK506-binding protein)ドメインとFRB(FKBP-rapamycin binding domain of FKBP12-rapamycin associated protein)ドメインをそれぞれPex15Δ30のN末端側に融合させたコンストラクトを酵母細胞内に発現させ,ラパマイシン依存的にFKBPドメインとFRBドメインを二量体化させるとPex15Δ30はMsp1の基質とならず,安定化することから,オーファンモデルが支持された48).出芽酵母のミトコンドリア外膜に局在する内在性のTAタンパク質Tom5, Tom6, Tom7はTOM(the translocase of the outer membrane)複合体の構成因子であり49),Gem1(GTPase EF-hand protein of mitochondria 1)はER-ミトコンドリア接触部位EMRES(ER-mitochondria encounter structure)複合体の構成因子である50).そして,Fis1はミトコンドリア分裂因子であるDnm1(dynamin-related 1)と相互作用する51).このように内在性のTAタンパク質はミトコンドリア膜上で複合体を作るために,Msp1の認識から逃れているのかもしれない.
3)Msp1を介した誤配送TAタンパク質の細胞内品質管理経路
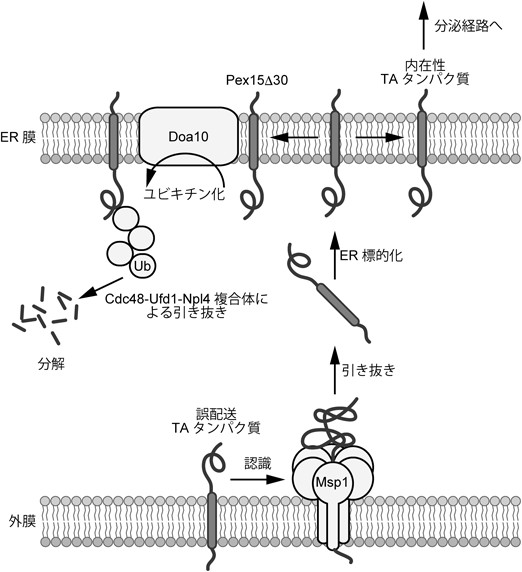
このように,2014年以降Msp1によるミトコンドリア誤配送TAタンパク質の認識や膜引き抜き機構に関する報告が相次いだ.しかし,Msp1によって膜から引き抜かれたTAタンパク質がどのようにして分解されるのかは,不明であった.そこで,筆者らは出芽酵母の分子遺伝学的および細胞生物的解析により,Msp1と連携して誤配送TAタンパク質の分解に関わる因子を探索した52).筆者らは,Pex15Δ30とGos1をモデル基質として用いた.その結果,筆者らは,Msp1がPex15Δ30を外膜から引き抜き,ERへ移行させることで,ER膜上のユビキチンリガーゼDoa10(degradation of alpha 10)複合体によるユビキチン化を促進すること,そしてユビキチン化されたPex15Δ30は,サイトゾルのAAA-ATPアーゼCdc48(cell division cycle 48)-Ufd1(ubiquitin fusion degradation protein 1)-Npl4(nuclear protein localization 4)複合体によって,ER膜から引き抜かれ,プロテアソームによって分解されることを明らかにした(図4)52).Dedererらは,筆者らとは独立にDoa10複合体がPex15Δ30のユビキチンリガーゼであることを,酵母単一欠損株ライブラリーを用いた遺伝学的スクリーニングによって発見したが,DedererらはMsp1によって引き抜かれたサイトゾルのPex15Δ30をDoa10がユビキチン化するという筆者らとは異なるモデルを提唱した48).
次に筆者らはミトコンドリアに誤配送されたGos1が,Msp1によってミトコンドリアからERに移行するが,Doa10によるユビキチン化を受けず,本来の局在場所であるゴルジ体まで移行することを見いだした(図4)52).Dedererらも,Gos1がDoa10の基質にはならないことを示した48).これらの結果は,Msp1によってERに移行したGos1はER膜上の品質管理システム(ER-associated degradation:ERAD)から異常とはみなされず,もとの目的地であるゴルジ体にまで正しく輸送されたことを示唆している.すなわち,Msp1は,ミトコンドリア外膜に誤配送されたTAタンパク質の分解だけに関与するのではなく,ERAD経路によって,異常とみなされなければ本来の目的地まで再配送の機会を与える因子としても働くことを意味している.以上のことから,筆者らはMsp1が誤配送TAタンパク質のERへの移行を促し,ER上での分解や本来局在するべき目的のオルガネラへの再配送の機会を与えることで,「局在化の校正」を行う膜引き抜き酵素として機能していることを明らかにした52).
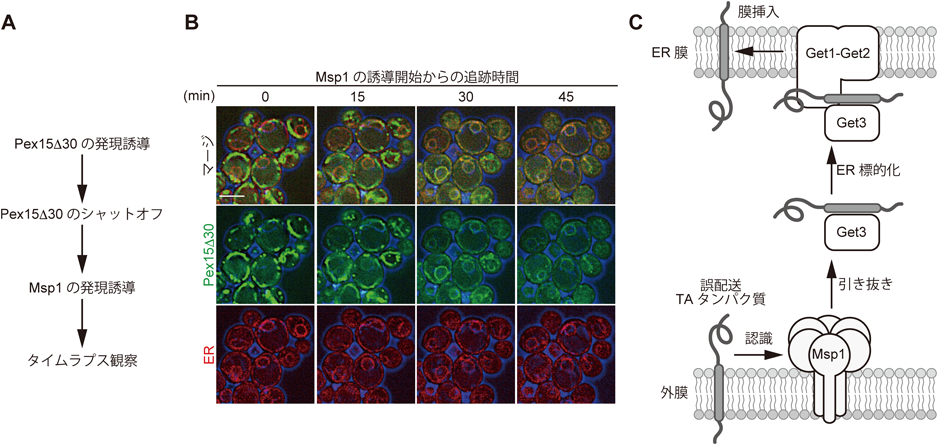
4)GET経路を介した誤配送TAタンパク質の再配送経路
次に筆者らは,Msp1によってミトコンドリア外膜から引き抜かれた誤配送TAタンパク質がどのようにERへ移行するのかについて調べるために,蛍光顕微鏡を用いたタイムラプス観察系を構築した53).このシステムは,Msp1とPex15Δ30の発現を,二つの異なる誘導型プロモーター(Z4EVプロモーターとDDI2プロモーター)を利用することで,厳密に制御できる点に特徴がある.まず,シアナミド誘導型DDI2プロモーターからPex15Δ30を発現誘導し,ミトコンドリアに誤配送させ,その後,培地からシアナミドを洗い流し,Pex15Δ30の発現をシャットオフする(図5A).Pex15Δ30のmRNAレベルを十分に減衰させた後,β-estradiol誘導型Z4EVプロモーターからMsp1を発現誘導し,この直後からタイムラプス観察を行った(図5A).その結果,Pex15Δ30のミトコンドリア局在が時間とともにERにシフトするようすが観察された(図5B).β-estradiolを添加せずにMsp1の発現を抑制した条件では,タイムラプス観察の期間,Pex15Δ30はミトコンドリアに局在していた.また,タイムラプス観察直前のPex15Δ30の残存mRNAをリアルタイムPCRによって定量すると,誘導開始のおよそ5%以下にまで減衰していたこと,そしてウエスタンブロットによってタイムラプス観察期間におけるPex15Δ30のタンパク質量は増加しないという実験結果からも,タイムラプス観察で捉えたMsp1依存的なPex15Δ30のER局在化は,リボソームで新規合成されたPex15Δ30が直接ERに移行したものではなく,ミトコンドリア上のPex15Δ30がMsp1によって引き抜かれ,ERに移行したことを強く支持した53).次に,筆者らはGET経路が欠損したget1/2Δとget3Δ株を用いて,Pex15Δ30のER局在が観察されなくなり,Pex15Δ30の分解が強く阻害されることを見いだした.Dedererらは,酵母単一欠損株ライブラリーを用いた網羅的なスクリーニングによって,GET経路の変異でPex15Δ30が安定化することをすでに発見していた48).しかし,DedererらはGET経路の変異によって,Doa10複合体を構成するユビキチン連結酵素(E2)の一つであるUbc6(ubiquitin conjugating enzyme 6)が,ミトコンドリアに誤配送されることでDoa10の活性が低下したことが,Pex15Δ30の安定化要因の一つであると主張した48).Ubc6はERに局在するTAタンパク質で,GET経路依存的にERに標的化することが過去に報告されていた15).そこで筆者らは,GET経路欠損による二次的影響の可能性を検証するために,ゲノム上のUBC6遺伝子に蛍光タンパク質(mNeonGreen)をノックインした酵母株を作製し,get1/2Δ株,get3Δ株における内在性Ubc6の局在を調べた.その結果,get1/2Δ株,get3Δ株において内在性のUbc6は主にER局在を示し,ミトコンドリアに誤配送されたUbc6の割合はわずかであった53).次に筆者らは,get3Δ株でDoa10のモデル基質Ste6*の安定性をシクロヘキシミドチェイス実験により調べたところ,Ste6*は野生型と同程度に分解されたことから,Dedererらが主張したGET経路の変異によりDoa10の活性が低下した可能性は低いと考えた.さらに筆者らは,免疫沈降実験によってPex15Δ30がMsp1に依存してGet3とサイトゾルで相互作用することを示した.以上の結果から,筆者らはPex15Δ30のER移行にGET経路が直接的に関与することを示した53).
次に筆者らは,内在性のTAタンパク質をミトコンドリアに誤配送させたときにMsp1とGET経路に依存してERへ再配送するのか,解析を進めた.内在性のTAタンパク質をミトコンドリアに誤配送させるためには,GET経路に変異を入れる必要がある.しかし,筆者らはミトコンドリアからERへのGET経路を介した再配送を調べるためには,GET経路の欠損株を利用することは難しいと考え,その代わりに植物ホルモンであるオーキシンを利用した分解(auxin inducible degradation:AID)法を用いた53).Get3にAIDデグロンタグを導入し,オーキシン依存的にGet3を分解することで,内在性のTAタンパク質Frt1をミトコンドリアに効率よく誤配送させることが可能となった53).AID法は可逆的であり,オーキシンを培地から洗い流すことで,2時間後にはGet3の発現量をオーキシンを添加する前の半分程度にまで回復させることができた.その後,β-estradiolを添加することでMsp1を発現誘導し,タイムラプス観察を行った結果,ミトコンドリア上に誤配送されたFrt1が時間経過でERに移行するようすが観察された53).Pex15Δ30のときと同様にβ-estradiolを添加せずMsp1を誘導しない条件では,誤配送Frt1はミトコンドリアに局在した.さらに,β-estradiolとオーキシンを同時に添加し,Msp1を発現させるが,Get3を分解した条件では,Frt1のシグナルはミトコンドリアから消失したが,ERには局在しない結果となった.このように,筆者らはミトコンドリアに誤配送された内在性のTAタンパク質もMsp1とGET経路を介してERに再配送されることを示した53).これまでにGET経路は新規合成されたTAタンパク質のER標的化経路として機能することが知られていたが,筆者らはミトコンドリアに誤配送されたTAタンパク質の再配送にも関わるというGET経路の新たな役割を明らかにした(図5C)53).
5)ミトコンドリアタンパク質輸送におけるMsp1の機能
ミトコンドリアに配送される前駆体タンパク質は,サイトゾルで合成された後,ミトコンドリア外膜のTOM複合体,TIM23(the translocase of the inner membrane 23)複合体を介して膜を通過する.脱共役剤でミトコンドリア膜電位を低下させたり,ミトコンドリアに移行する前駆体タンパク質を過剰発現させると,前駆体タンパク質が細胞内に蓄積したり,TOM複合体内に穴詰まりする.細胞はミトコンドリアタンパク質輸送が障害されると,分子シャペロンやプロテアソーム関連遺伝子の発現を上昇させ,呼吸鎖などミトコンドリアタンパク質の発現を低下させる54).さらに,転写因子Pdr3の活性が上昇し,Cis1(citrinin sensitive knockout 1)の発現が促される54, 55).Cis1はミトコンドリア外膜上に局在し,TOM複合体の受容体サブユニットTom70と結合し,Msp1をリクルートすることで,TOM複合体内で穴詰まりした前駆体タンパク質の分解除去に関わることが示され,このような細胞応答はmitoCPR(mitochondrial compromised protein import response)と呼ばれる55).
6)ペルオキシソーム生合成異常とMsp1/ATAD1との関連
ペルオキシソームは,極長鎖脂肪酸のβ酸化,胆汁酸合成,過酸化水素分解などを行う一重膜のオルガネラである.ペルオキシソーム生合成の必須因子はペルオキシン(Peroxin)と呼ばれ,Peroxin遺伝子の変異はペルオキシソーム形成異常症(peroxisome biogenesis disorder:PBD)を引き起こす.Zellweger症候群(Zellweger spectrum disorder:ZSD)はPBDの中でも最も重症度が高く,ZSDモデルの細胞ではペルオキシソームが機能不全となるだけでなく,ミトコンドリアの機能も障害されることが知られていた56).ZSD患者由来の細胞では,Peroxinのいくつかがミトコンドリアに誤配送されることで,機能的なタンパク質輸送体が形成されることが明らかとなった56).さらに,ATAD1をZSD患者由来の細胞内で過剰発現することで,誤配送Peroxinが除去され,ミトコンドリアの呼吸活性や代謝が部分的に回復することが示された56).
4. P5A型ATPアーゼSpf1を介した誤配送TAタンパク質の細胞内品質管理経路
ミトコンドリアに配送される前駆体タンパク質は,輸送経路を阻害したり,ミトコンドリア局在化シグナルをマスクしたりするとERに誤配送されることがある57–59).このようなミトコンドリア膜タンパク質のER標的化(誤配送)にGET経路が関与することが報告されている57, 59).また,ERに移行したミトコンドリア膜タンパク質がER表面を経由してミトコンドリアに移行する,ER-SURF経路の存在が近年明らかになった57).ER-SURF経路は,ER膜が前駆体タンパク質を捕まえる虫取り網のような働きを持ち,ER表面に局在する分子シャペロンDjp1(dnaJ protein 1)が前駆体の凝集を防ぐことで,ミトコンドリアに移行できる状態を最大限保つ機構であると考えられている60).一方で,ER膜に停滞しミトコンドリアへの移行に失敗した前駆体は,ER膜タンパク質Ema19(efficient mitochondria targeting-associated protein 19)を介したERAD経路によって分解される61).
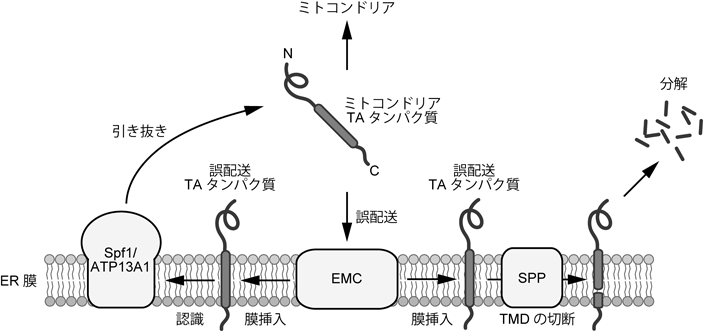
酵母変異株ライブラリーを用いてミトコンドリアTAタンパク質の局在化に影響する遺伝子をスクリーニングした結果,SPF1(sensitivity to Pichia farinosa killer toxin 1)欠損酵母株において,ミトコンドリアTAタンパク質Fis1やGem1がERに誤配送されることが見いだされた33).SPF1遺伝子はER膜上に局在するP5A型ATPアーゼをコードする.spf1Δ株ではERストレス誘導剤であるツニカマイシンに対する感受性の増加や,ERAD基質の分解遅延など,ERのプロテオスタシスに重要な因子であることが報告されていたが,その機能は不明であった62, 63).P型ATPアーゼはATP依存的に陽イオンや低分子を能動輸送するイオンポンプであり,Spf1は既知のファミリータンパク質との類似性や欠損株の表現型からカルシウムイオンやリン脂質の輸送に関わると予想された64).また,spf1Δ株でミトコンドリアTAタンパク質がERに誤配送されるのは,ERとミトコンドリア間のエルゴステロールバランスが異常になることで,ミトコンドリアTAタンパク質がER膜に自発的に挿入されやすくなった二次的な影響の結果であると考えられてきた33).Spf1の線虫ホモログCATP-8の変異においても,ミトコンドリアTAタンパク質がERに誤配送されることが報告されている65).近年McKennaらは,意外なことにSpf1がERに誤配送されたミトコンドリアTAタンパク質をATP依存的に膜から引き抜くタンパク質であることを報告した66).McKennaらは,RRLで合成した光架橋性アミノ酸を導入したOmp25を出芽酵母から単離したERとミトコンドリアなどを含む膜画分に取り込ませ,Omp25と光架橋されたタンパク質としてSpf1を同定した.McKennaらは,哺乳動物細胞を用いてSpf1のヒトホモログATP13A1を欠損させると,ミトコンドリアTAタンパク質がERに誤配送されること,そしてミクロソーム画分を用いたin vitro系により,ATP依存的なATP13A1の膜引き抜き活性を示した66).さらに,McKennaらは,クライオEMによる構造解析から,Spf1のTMDにはαヘリックス1本分を収容できるポケットが存在することを明らかにした66).McKennaらのデータが正しいとすれば,ミトコンドリアTAタンパク質は本来ERへ誤配送されやすい性質を持ち,Spf1/ATP13A1の働きによって局在化が校正されることでミトコンドリアに精度高く局在化するモデルが考えられる(図6)66).この報告に続き,McKennaらは,ATP13A1欠損細胞で観察されるミトコンドリアTAタンパク質のER局在化にEMCが関与すること,そしてATP13A1欠損細胞でER膜上に蓄積したミトコンドリアTAタンパク質は,SPP(signal peptide peptidase)によりTMDが切断された後,ERAD経路で分解されることを示した(図6)67).さらに,McKennaらは,ATP13A1はミトコンドリアTAタンパク質だけでなく,N末端に1本のTMDもしくはシグナル配列を持つERタンパク質をサイトゾルへ引き抜くことで,正しい膜トポロジー形成を促すことも示し,ATP13A1の多彩な機能を提唱した67).