リン酸化やメチル化に代表される「タンパク質翻訳後修飾」は,タンパク質の機能・動態制御や細胞内シグナル伝達で重要な役割を果たしている.ヒトプロテオーム中では,10,000以上のタンパク質の40,000か所以上の残基が520種類以上のキナーゼによりリン酸化され,約150種のホスファターゼにより脱リン酸化される.この膨大で複雑なリン酸化/脱リン酸化によるタンパク質の機能・相互作用制御の全貌を解明することは,細胞機能およびその破綻による機能低下・喪失のメカニズムを知る上で必要不可欠である.これまで,リン酸化をはじめとする翻訳後修飾がタンパク質の機能を制御する仕組みは,「部位特異的」「立体構造特異的」な効果として理解されてきた.しかし,近年のプロテオミクス解析は,リン酸化は立体構造をとらない領域(IDR,後述)に主に生じることを示す.はたして,40,000か所以上のリン酸化は本当に「部位特異的」にタンパク質の機能を制御しているのか.もしそうでないなら,他にどのような仕組みがあるのか,もしくは,多くのリン酸化は何もしない単なるノイズなのか.ここでは,リン酸化にまつわるこの未解決の問題を取り上げるとともに,近年の新しい知見について概説することで,リン酸化研究の新しい方向性を議論したい.
2. リン酸化がタンパク質の機能を制御する仕組み~カギとカギ穴~
タンパク質の機能(酵素活性や複合体形成など)には,ポリペプチド鎖が折りたたまれてでき上がる「立体構造」が重要な役割を果たしている.立体構造が酵素–基質の特異性を生み出し,タンパク質間相互作用の特異性を決定する.教科書では「カギ」と「カギ穴」にたとえられるこの「立体構造特異性」は,タンパク質の機能を理解する上で最も重要な概念である.結晶構造解析や核磁気共鳴法,電子顕微鏡による単粒子解析などを用いてタンパク質の立体構造を解明する意義は,まさにここにあるといってよい.これは,タンパク質の機能のみならず,その機能制御の仕組みにも当てはまる.タンパク質の機能がリン酸化に代表される翻訳後修飾により複雑に制御される1)ことも,「立体構造特異性」に基づいて理解できる.
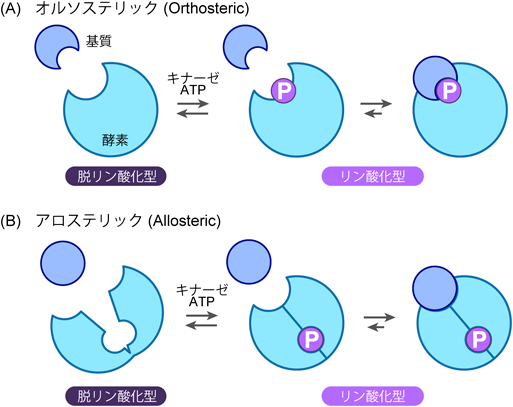
タンパク質リン酸化は,アデノシン5′-三リン酸のγ位のリン酸基が,セリン,トレオニン,チロシン側鎖の水酸基に転移される化学反応である.リン酸基のような小さな官能基の付加が,タンパク質のような大きな生体分子の機能を変化させるカラクリは,「立体構造特異性」である.カギとカギ穴の対応を変化させるには,いずれかの構造を大きく変える必要はなく,部分的なわずかな変化でよい.酵素–基質間相互作用であれば,酵素の基質結合部位(ポケット)近傍に,またタンパク質間相互作用であれば,相互作用面内にリン酸基が付加されれば,相互作用を変化させることが可能である(図1A)(オルソステリック効果).また逆に,リン酸基がない場合はうまくフィットしないが,リン酸基の付加によりフィットすることもある.いずれにせよ,リン酸基が「立体構造特異性」を変化させることで,タンパク質機能を正もしくは負に制御する.
リン酸基が付加される場所は,必ずしも相互作用部位付近でなくてもよい.リン酸基の付加がタンパク質の立体構造そのものを変化させることで,間接的に結合部位の立体構造が変化し,それが結果的に基質もしくは相手のタンパク質との相互作用を変化させる場合がある(図1B)(アロステリック効果)2).しかし,いずれの場合でも,「ステリック」という名のとおり,「立体構造特異性」が変化していることは共通している.
3. リン酸化に関する矛盾~タンパク質のリン酸化の多くは非構造領域に生じる~
ヒトプロテオームに生じる40,000か所のリン酸化は,すべて前述の「立体構造特異的」な仕組みで働いているのであろうか.ヒトプロテオーム中のタンパク質は22,000種程度なので,平均すると,一つのタンパク質に1個以上のリン酸化が生じることになる.実際には,リン酸化を受けないタンパク質が半数ほどあるため,残りの半分のタンパク質は複数個のリン酸化を受ける.多いものだと100か所以上のリン酸化を受ける.これらがすべて「立体構造特異的」制御を行うとすると,その組合わせの数から考えても想像を絶する複雑さである.
一方で,プロテオミクスとバイオインフォマティクスを用いた研究手法の進歩により,リン酸化部位の特徴が徐々に明らかにされてきた.2000年代初頭から,リン酸化は,ポリペプチド鎖の中でも立体構造をとりにくい領域[天然変性領域(intrinsically disordered region:IDR)]に多く生じることが報告されていた3–5).IDRは,その特徴的なアミノ酸組成から,予測が比較的容易である6, 7).親水性アミノ酸に富む,グリシンやプロリンなどの二次構造をとりにくいアミノ酸が多い,などの特徴があり,疎水性相互作用によるポリペプチド鎖の折りたたみが進行しにくい.これらの報告では,解析対象としたリン酸化部位の約8割近くがIDRに存在するという結果が得られたが,この時点ではあまり注目されることはなかった.その理由の一つには,解析対象数が少なかった(2004年の論文では1500か所,2008年の論文では512か所)ことがあげられる.また,IDRの定義も定まっておらず,立体構造をとる領域の表面に存在する短い「ループ」もIDRとしてカウントすれば,IDRにリン酸化が多いのは当たり前であるという解釈も可能だからである.リン酸化はキナーゼにより触媒されるため,折りたたまれたタンパク質の「内部」よりも「表面」に生じやすいのは当たり前ではないかと考えられた.
その後,プロテオミクス技術の飛躍的進歩により,リン酸化部位の情報が増え続けても(10,000以上),同様の統計的結果が得られた8–10).また,リン酸化のみならず,アセチル化やメチル化などの翻訳後修飾も同様の傾向があることも報告された9).短いIDRではなく,数十アミノ酸長以上の長いIDRに限定しても,同じ結論が得られたことから,「立体構造表面の短いループに生じやすい」という説は支持されない.さらに興味深いことに,一つのIDRには複数のリン酸化がきわめて近い距離(最も近いリン酸基が5~10残基以内)で入ることも示された8, 11, 12).この「群がる」性質は,IDR外に入るリン酸化よりも,IDR内のリン酸化に強くみられる12).我々が2020年に発表した論文では,分裂期移行に伴うリン酸化を網羅的に同定・定量解析し,約10,000か所のリン酸化セリン/トレオニン残基のうち約6割がIDR(30残基長以上)に存在することを示した10).すべてのセリン/トレオニン残基の約2割がIDRに存在することをふまえると,有意に高い数値である.
上記の一連の統計的事実は,リン酸化の「立体構造特異的」制御機構とは明らかに矛盾している.そもそも立体構造を持たないポリペプチド鎖に付加されたリン酸基が,「立体構造特異性」を変化させることはありうるのか.可能性としては,リン酸化によりIDRが立体構造を獲得するケースが考えられる.しかし,ごく短いペプチドの例13)を除けば,このような現象は報告されていない.さまざまなペプチドを用いた実験や,構造シミュレーションが行われたが,この可能性を支持する結果は得られていない.もしくは,リン酸基の付加がinduced fitを可能にするケースもある.CREB(cyclic AMP-responsive element-binding protein)とCBP(CREB-binding protein)との相互作用はこの例である.CREB内のkinase-inducible domainはIDRであるが,その中のSer133がリン酸化されると,CBP内で立体構造を持つKID領域と相互作用し,αヘリックスを形成した状態で結合する.このようなIDRと立体構造領域との相互作用をさらに拡大すると,長いIDRが複合体形成や細胞内シグナル伝達の「ハブ」として機能しているという考え方が生まれる14, 15).特定の立体構造を持たない柔軟なポリペプチドであるがゆえに,複数のタンパク質と相互作用し,柔軟にそのパートナーを変えることができる(HMGA, α-synuclein, caldesmon等はその例).その柔軟な相互作用ネットワークがリン酸化により制御される可能性は大いにある.しかしながら,現時点ではこのような報告例は限定的であり,40,000か所に及ぶリン酸化部位を説明するには足りない.我々は,リン酸化を理解したような気になっていたが,実はそのごく一部しか理解していなかったのである.
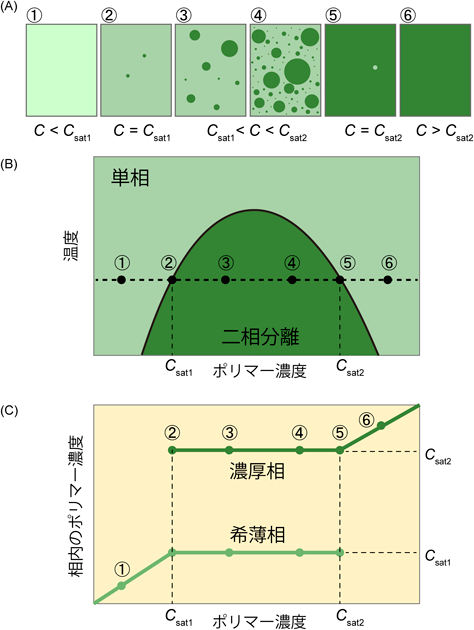
リン酸化から少し離れて,IDRの研究に目を向けると,2013年ごろから液–液相分離の研究が急激に進み,IDRは新たに脚光を浴びることになった.核小体やストレス顆粒等に代表される「細胞内非膜オルガネラ」の形成原理として,これまで物理化学分野で研究されてきた相分離・相転移が,生物学でも注目を集めることになった.細胞内の液–液相分離では,IDRどうしの弱い相互作用,もしくはRNAなどの核酸とIDR間の相互作用が分子の集合を生み出し,濃度の高い相(濃厚相)と低い相(希薄相)の,濃度が異なる二層が出現する(図2).立体構造特異的な相互作用が「強い」相互作用であれば,こちらは「弱い」相互作用であるが,それが分子内に数多く生じる(多価相互作用)ことで,動的な分子集合が生じる.「弱い」相互作用の正体は,静電相互作用やカチオンπ相互作用であると考えられている.よって,すべてのIDRが液–液相分離を引き起こすわけではなく,その強さはアミノ酸組成や配列に依存する.現在,液–液相分離に関する多くのデータベースが作られ,さまざまな情報が集約されている.
タンパク質・核酸液–液相分離の衝撃は,タンパク質科学・生物物理学のみならず,細胞生物学,分子生物学にもまたたく間に広がった.これまで「立体構造」の解明こそがタンパク質機能解明のカギであるという方向性に,新たな分岐点が出現したのである.これまで,分子間相互作用の評価に広く用いられてきた解離定数(Kd)が使えない相手が現れたのである.しかも,IDRはヒトプロテオームの約半分を占めるため(IDRの定義により4~6割の範囲),無視することはできない.この「形なき者」を相手とする研究は,全世界の研究者を魅了し,爆発的速度で進行した.その詳細は,多くの総説がすでに発表されているので,そちらを参照していただきたい16–19).
IDRが液–液相分離の主役の一つとして脚光を浴びると,リン酸化などの翻訳後修飾がその「制御」を担っていると考えるのは自然な流れである.実際,リン酸化が液–液相分離や細胞内非膜オルガネラの形成・崩壊を制御する例が報告された20–24).これはどのように理解すればよいのか.特定残基における負電荷の増加がIDRどうしの静電相互作用,さらにはそれらの巨視的な振る舞いを変化させたのであろうか.液–液相分離がIDRの多価相互作用で引き起こされていることをふまえると,それは難しいように思える.前述のように,IDRと立体構造を持つドメイン間の相互作用であれば,induced fitの考え方が可能であったが,IDRの液–液相分離の場合も可能であろうか.それとも,IDRの総電荷が負に傾くことが重要なのであろうか.
5. リン酸化の「電荷ブロック」効果による液–液相分離の制御
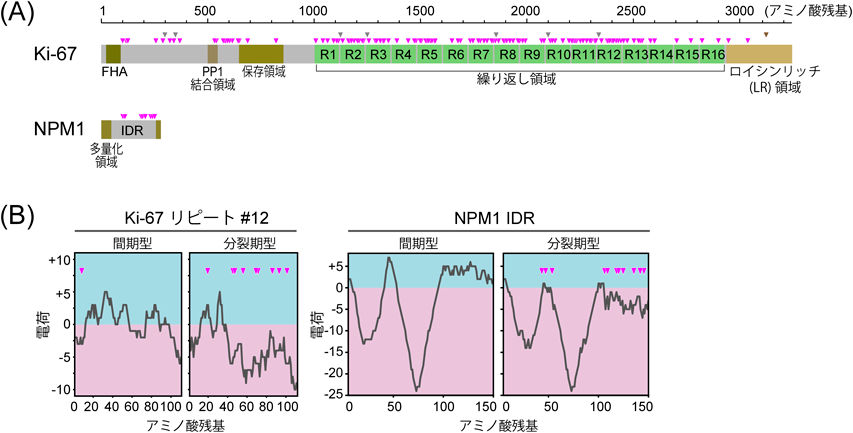
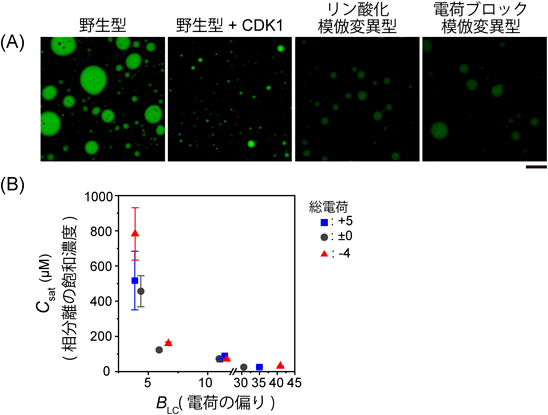
このような状況で,我々の研究グループでは,リン酸化がいかに液–液相分離を制御するかを解明すべく研究を行い,リン酸化による「電荷ブロック」の変化が液–液相分離を制御しうることを突き止めた25).その研究では,分裂期移行に伴うリン酸化に注目した.細胞周期がG2からM期へ移行する際に,CDK1/cyclin B等のキナーゼが多くのタンパク質をリン酸化し,これが引き金となって細胞内で大規模な構造変化(核膜消失,染色体凝縮,動原体・紡錘糸形成など)が進行する.核小体は,間期では液相非膜オルガネラとして核内に存在するが,分裂期移行に伴い核小体は崩壊・離散し,構成タンパク質の多くは細胞質に拡散するか,もしくは染色体辺縁部(chromosome periphery)という新たな液相非膜オルガネラを形成する.NPM1は,間期核小体の液–液相分離の主要なタンパク質であり,分裂期キナーゼでリン酸化されることが知られていた.一方,Ki-67は,間期核小体の周囲に結合し,分裂期移行とともにリン酸化され,染色体辺縁部を形成する主要な構成要素となる.我々が行った比較定量質量分析では,NPM1で11, Ki-67では77の残基でリン酸化が上昇する10)(図3A).
我々は,Ki-67とNPM1のIDRにおける電荷分布に注目した.NPM1は中央部に約150アミノ酸残基長のIDRを持ち,正と負の電荷の偏りがみられる領域(電荷ブロック)が交互に並んでいる(図3B).このプロットに11か所の分裂期リン酸化残基を重ねると,二つの正電荷ブロック内に集中していることがわかる(図3B,矢頭).リン酸化残基を−2の負電荷として計算すると,分裂期リン酸化型では,二つの正の電荷ブロックが消失している.一方,Ki-67では,分裂期リン酸化は,中央部のリピートドメインに集中している(図3B).その一つに着目すると,間期型(非リン酸化型)では,正のブロックのみがみられるが,分裂期型で九つのリン酸化が生じると,前半の正電荷ブロックはそのままで,後半に負電荷ブロックが出現する.実は,この正・負の電荷ブロックと,液–液相分離との間には密接な関係が存在する.
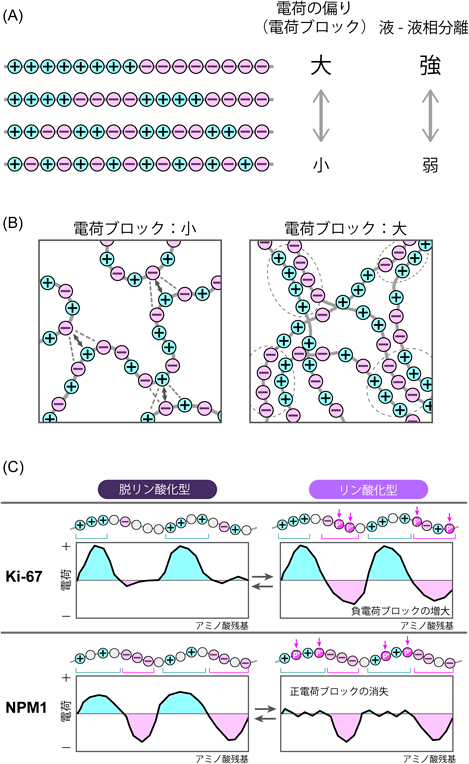
ソフトマター物理学の分野では,荷電ポリマーにおける電荷分布と相分離との関係性に関する研究が以前から行われてきた.たとえば,同数の正,負に荷電したモノマーから構成される荷電ポリマー(総電荷は0)の場合,鎖上の電荷の偏りと液–液相分離との間に正の相関があることが報告されている26–29).つまり,正と負が交互に並ぶポリマーと,正と負が両端に完全に分極して並ぶポリマーとでは,後者の方が相分離を起こしやすいのである(図4A).この仕組みはまだ完全には解明されていないが,おそらく,分子間におけるモノマーどうしの静電相互作用を考えたときに,電荷の偏りが小さいと,隣接する対電荷が分子間静電相互作用を打ち消す(弱める)効果を発揮するからであると考えられている.つまり,電荷が偏っている方が,対電荷が近傍に存在せず,より強い分子間相互作用が得られると考えられる(図4B).この事実を,NPM1とKi-67のリン酸化に適用すると,NPM1では,リン酸化により正・負交互の電荷ブロックが消失しているので相分離が「抑制」される方向に,逆にKi-67ではリン酸化により電荷ブロックが出現しているので相分離を「促進」する方向に働くという仮説が成り立つ(図4C).
この仮説を検証すべく,in vitroおよびin vivoでさまざまな実験を行った結果,仮説を支持する結果が得られた.たとえば,大腸菌で発現・精製したNPM1のIDRは,in vitroで強い相分離を示す.これをCDK1/Cyclin B1でリン酸化すると相分離能は顕著に低下する(図5A).分裂期にリン酸化される11残基をすべてグルタミン酸(E)に置き換えたリン酸化模倣変異体でも,同様に相分離能が顕著に低下していた(図5A).さらに,本来であればリン酸化されない残基をEに置き換えて,電荷ブロックの分布がリン酸化型によく似た人工タンパク質を作製すると,リン酸化型と同様,相分離能が低下していた(図5A).Ki-67に関しても同様の結果が得られ,IDR上の電荷の偏りと,相分離の臨界濃度との間には,強い負の相関があることがわかった(図5B).
「電荷ブロック」型制御の特徴と重要性は,以下にまとめられる.
- ①特定のアミノ酸残基のリン酸化ではなく,より巨視的な「ブロック」の電荷変化が重要である.
- ②単一ポリマー系の場合,正・負両方のブロックが存在すると相分離は促進される.片方の電荷ブロックしかない場合,もしくは明確なブロックが存在しない場合,相分離は生じにくい.
- ③ブロックの大きさは,数十アミノ酸であることが多い.
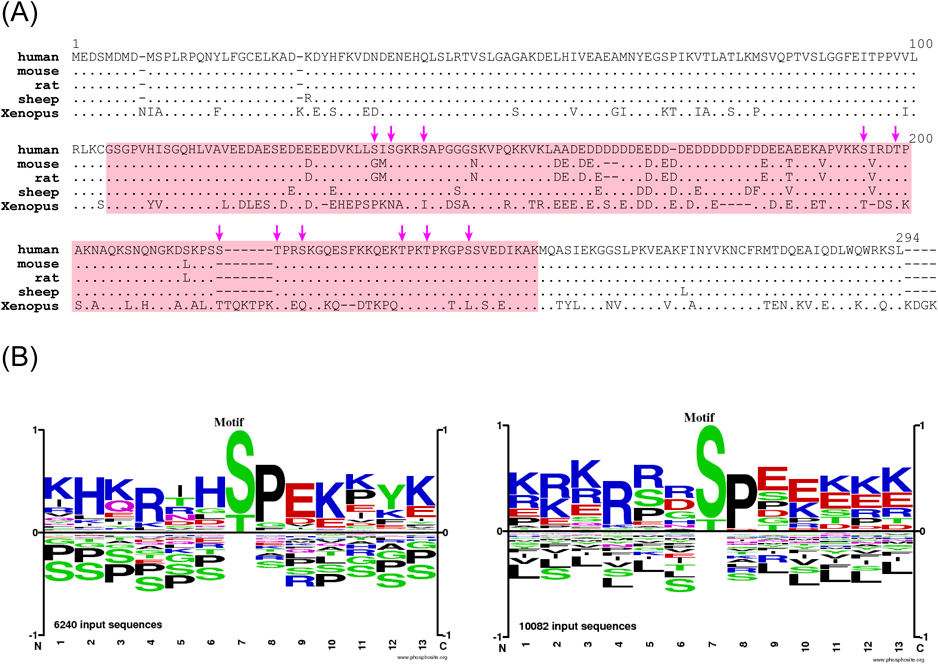
特に①の特徴は,従来の「立体構造特異的」なリン酸化制御の仕組みとはまったく異なるという点で重要である.前述のとおり,従来の考え方では,リン酸化部位は立体構造上の特定の部位に生じることが重要である.よって,多くの重要なリン酸化部位は,種間で保存性が高い.これに対して,「電荷ブロック」型制御では,残基レベルでの特異性は必要ない.数十アミノ酸程度の「巨視的」な領域の総電荷が重要である.そもそもIDRは,立体構造をとる領域に比べると,アミノ酸保存性が低い.これは,立体構造のバイアスが低いのが主な理由であるが,リン酸化部位の保存性も当然低い.NPM1の場合を例にあげると,ヒトとマウスでは,構造領域のアミノ酸同一性が100%であるのに対して,IDR内では88%(128/146)程度であり,ヒトの11個の分裂期リン酸化残基のうち,保存されているのは9個(82%)である.ヒトとアフリカツメガエルでは,構造領域が76%,IDRが51%の同一性であり,保存されているリン酸化部位は11個中で4個だけである(図6A).
「電荷ブロック」型制御は,リン酸化はなぜIDRに入るのかという問いに答えを与えるのみならず,なぜ群がるのか,という問題に対しても答えを与えうる.一つのリン酸基だけでは「ブロック」の電荷を変化させることはできないため,「群がる」必要があると考えられる.この原理に基づいてヒトプロテオーム内のIDRの電荷分布を解析すると,NPM1, Ki-67以外にも多くのタンパク質でIDRの電荷ブロックを見いだすことができる25).これらのタンパク質がリン酸化による電荷ブロック制御を受けているかどうかは,今後の研究成果を待たねばならない.そのためには,リン酸化を比較定量する技術が必要不可欠である.これまでのリン酸化部位の検出は定性的であり,リン酸化データベースには,残基の情報は含まれるが量的変化に関する情報はほとんどない.リン酸化プロテオミクス技術のさらなる進歩30, 31)に期待するとともに,インフォマティクス的アプローチによる網羅的解析も必要になると思われる.ちなみに,ヒトプロテオームを対象とした最新のリン酸化質量分析で同定されたリン酸部位から,IDRに存在するものを抽出して,近傍アミノ酸をロゴ解析すると,+1のプロリン残基(CDKやMAPKのコンセンサス配列)以外は,−6から+6まで,塩基性アミノ酸がまんべんなく高い頻度で検出される(図6B).これは,正の電荷ブロックを減弱させるリン酸化が多いことを示唆しているとも解釈できる.
7. 電荷ブロック型制御が生み出す新しい制御機構の可能性
「電荷ブロック」型制御は,「立体構造特異的」な仕組みでは説明困難な,液–液相分離の制御機構を提供するのみならず,さらにマクロな視点での系の活性制御機構に関しても興味深い仕組みを提供してくれる.
1)ロバストネスと非線形を生み出す仕組み
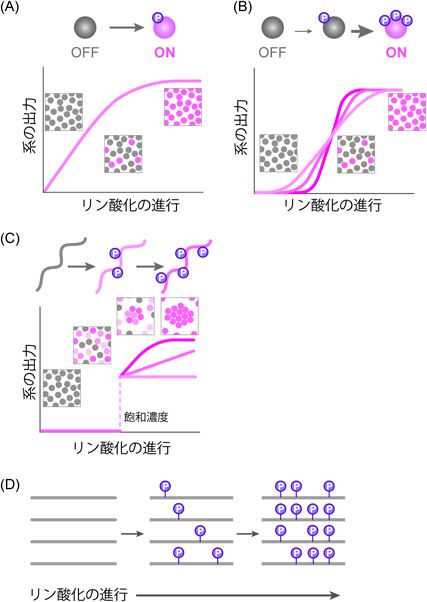
生物学の教科書でよく目にする,リン酸化・脱リン酸化がタンパク質の機能をON・OFFする場合を考える.「立体構造特異的」制御でよくみられるこのようなケースでは,個々のタンパク質分子に注目すると,ONとOFFの2状態しかなく,その間は不連続である.系に多くのタンパク質分子が存在するとき,系内のキナーゼ活性が高いほど,ON状態の分子数が増える.その結果,入力(キナーゼ活性)と出力(タンパク質の機能・活性)と間には線形性がみられ,やがて飽和する(図7A).もし複数のリン酸化が協調的に活性化に関与する場合,線形ではなくシグモイドカーブになり,協調性が高いほどその傾きは大きくなる(図7B).
これに対して,「電荷ブロック」による液–液相分離制御系は,まったく異なる挙動を示す.リン酸化により液–液相分離が亢進する場合,濃厚相の形成を出力(タンパク質機能)とすると,非リン酸化状態では,系全体の出力は0である.キナーゼ活性が上昇するにつれて系内のリン酸化が進行するが,しばらくの間は相分離が生じない(図7C).つまり出力は0のままである.さらに入力が上昇し,いわゆる「臨界濃度」や「飽和濃度」と呼ばれる点に到達すると,ようやく相分離が始まる.この濃度は,二成分系相分離の場合,ポリマー濃度を上昇させていったときに相分離が生じ始める点として定義されるが,リン酸化の場合は,系内のリン酸基の上昇によって相分離し始める点と置き換えられる.よって,臨界点以下では,系の出力は入力値の変化に対して強いロバストネスを持つ.実は,そもそも相分離の現象自体が,転写レベルの揺らぎに起因するタンパク質の濃度変化をキャンセル(緩衝)する仕組み(ノイズキャンセリング)として機能しているという考え方もあり32),これにより細胞質(希薄相)と非膜オルガネラ(濃厚相)のポリマー濃度が一定に保たれていると考えられている33).このように,相転移現象は,系の揺らぎに対して強いロバストネスを示す.
一方,リン酸化が臨界点を超えると,相分離により系の出力は急上昇し,その後は系の成分数等に応じて一定値か上昇傾向がみられる(図7C).臨界点以下がロバストネスを示したのに対して,臨界濃度付近では,わずかな入力の変化で不連続な出力が得られることになる.これは,協調的機構によるシグモイド曲線よりもシャープな反応であろう.相分離系では,複数のリン酸化部位の間に協調性は必要ない.おそらく,系内のリン酸化が進行するに従って,リン酸化状態が異なるヘテロな分子集団が形成されると思われる(図7D).その総量が臨界点以下であれば,相分離は起こらず,それ以上だと相転移が進行する.このように,リン酸化が相分離を制御する系では,ヘテロな分子集団が示す巨視的振る舞いにより,入力(キナーゼ活性)と出力(基質タンパク質の機能)の間に強い非線形性が生み出される.これが細胞内のどこで機能しているかは,今後の研究成果を待つ必要があるが,「立体構造特異的」制御だけでは困難な仕組みを,相分離は可能にしているという点は興味深い.
2)他の翻訳後修飾による電荷ブロック制御の可能性
リン酸化に加え,他の翻訳後修飾も液–液相分離を制御する例が示されている34, 35).リン酸化が電荷的に中性なアミノ酸側鎖(セリン,トレオニン,チロシン)に負電荷を付加することで電荷ブロックを変化させるのであれば,電荷の変化を伴う翻訳後修飾でも同様の原理が働いている可能性が高い.前述のバイオインフォマティクス解析では,リン酸化のみならず,アセチル化やメチル化もIDRに生じやすく,かつ群がる傾向がある9).アセチル化は,リシンおよびアルギニン残基側鎖のアミノ基にアセチル基が共有結合する反応であり,これによりアミノ基の正電荷(+1)が消失する.ということは,脱アセチル化状態では存在していたIDR中の正電荷ブロックが,アセチル化により消失することで,液–液相分離を制御する可能性もある.また,メチル化は,アセチル化と同様,リシンとアルギニン残基側鎖のアミノ基にメチル基が付加される反応であるが,アセチル化と異なり,アミノ基の正電荷は消失しない.しかし,メチル基という疎水性官能基により,アミノ基の正電荷がマスク(シールド)されると考えられている.特に,ジメチル,トリメチル化の場合,その効果はより大きくなる.よって,アセチル化と同様,メチル化による正電荷ブロックの消失が液–液相分離を制御している可能性も十分に検討に値する.現時点ではこれらの事実を示す実験結果は得られておらず,すべてのメチル化やアセチル化がこの原理で働いているわけでないと考えられるが,今後の検討が期待される.
翻訳後修飾による液–液相分離の制御は,細胞内液相非膜オルガネラの構造・機能のダイナミクスを理解する上で重要な仕組みである.これまで多くの例が報告されてきたが,その多くは現象の記述にとどまっていた.ここで解説した「電荷ブロック」型の制御機構は,従来の「立体構造特異的」とはまったく異なる仕組みで相分離を制御する.これですべてのリン酸化が説明できるわけではないが,翻訳後修飾の研究に新しい1ページを記したことは確かであろう.今後,より深い原理の解明やそれに基づいた現象の記述が待たれる.
謝辞Acknowledgments
原稿を丁寧に読み,多くのアドバイスをいただいた徳島大学の小迫英尊先生,東京大学の山﨑啓也先生に心より感謝申し上げます.
引用文献References
1) Johnson, L. & Lewis, R. (2001) Structural basis for control by phosphorylation. Chem. Rev., 101, 2209–2242.
2) Nussinov, R., Tsai, C., Xin, F., & Radivojac, P. (2012) Allosteric post-translational modification codes. Trends Biochem. Sci., 37, 447–455.
3) Iakoucheva, L.M., Radivojac, P., Brown, C.J., O’Connor, T.R., Sikes, J.G., Obradovic, Z., & Dunker, A.K. (2004) The importance of intrinsic disorder for protein phosphorylation. Nucleic Acids Res., 32, 1037–1049.
4) Jiménez, J.L., Hegemann, B., Hutchins, J.R.A., Peters, J.M., & Durbin, R. (2007) A systematic comparative and structural analysis of protein phosphorylation sites based on the mtcPTM database. Genome Biol., 8, R90.
5) Collins, M.O., Yu, L., Campuzano, I., Grant, S.G.N., & Choudhary, J.S. (2008) Phosphoproteomic Analysis of the Mouse Brain Cytosol Reveals a Predominance of Protein Phosphorylation in Regions of Intrinsic Sequence Disorder. Mol. Cell. Protom, 7, 1331–1348.
6) Dosztányi, Z., Csizmók, V., Tompa, P., & Simon, I. (2005) The pairwise energy content estimated from amino acid composition discriminates between folded and intrinsically unstructured proteins. J. Mol. Biol., 347, 827–839.
7) Dosztányi, Z., Csizmók, V., Tompa, P., & Simon, I. (2005) IUPred: web server for the prediction of intrinsically unstructured regions of proteins based on estimated energy content. Bioinformatics, 21, 3433–3434.
8) Pejaver, V., Hsu, W.L., Xin, F., Dunker, A.K., Uversky, V.N., & Radivojac, P. (2014) The structural and functional signatures of proteins that undergo multiple events of post-translational modification. Protein Sci., 23, 1077–1093.
9) Darling, A.L. & Uversky, V.N. (2018) Intrinsic Disorder and Posttranslational Modifications: The Darker Side of the Biological Dark Matter. Front. Genet., 9, 158.
10) Yamazaki, H., Kosako, H., & Yoshimura, S.H. (2020) Quantitative proteomics indicate a strong correlation of mitotic phospho-/dephosphorylation with non-structured regions of substrates. Biochim. Biophys. Acta. Proteins Proteomics, 1868, 140295.
11) Li, H., Xing, X., Ding, G., Li, Q., Wang, C., Xie, L., Zeng, R., & Li, Y. (2009) SysPTM: a systematic resource for proteomic research on post-translational modifications. Mol. Cell. Proteomics, 8, 1839–1849.
12) Schweiger, R. & Linial, M. (2010) Cooperativity within proximal phosphorylation sites is revealed from large-scale proteomics data. Biol. Direct, 5, 6.
13) Espinoza-Fonseca, L.M., Kast, D., & Thomas, D.D. (2008) Thermodynamic and structural basis of phosphorylation-induced disorder-to-order transition in the regulatory light chain of smooth muscle myosin. J. Am. Chem. Soc., 130, 12208–12209.
14) Dunker, A.K., Cortese, M.S., Romero, P., Iakoucheva, L.M., & Uversky, V.N. (2005) Flexible nets. The roles of intrinsic disorder in protein interaction networks. FEBS J., 272, 5129–5148.
15) Kim, P.M., Sboner, A., Xia, Y., & Gerstein, M. (2008) The role of disorder in interaction networks: a structural analysis. Mol. Syst. Biol., 4, 179.
16) Zhu, L. & Brangwynne, C.P. (2015) Nuclear bodies: the emerging biophysics of nucleoplasmic phases. Curr. Opin. Cell Biol., 34, 23–30.
17) Banani, S.F., Lee, H.O., Hyman, A.A., & Rosen, M.K. (2017) Biomolecular condensates: organizers of cellular biochemistry. Nat. Rev. Mol. Cell Biol., 18, 285–298.
18) Choi, J.M., Holehouse, A.S., & Pappu, R.V. (2020) Physical Principles Underlying the Complex Biology of Intracellular Phase Transitions. Annu. Rev. Biophys., 49, 107–133.
19) Lafontaine, D.L.J., Riback, J.A., Bascetin, R., & Brangwynne, C.P. (2021) The nucleolus as a multiphase liquid condensate. Nat. Rev. Mol. Cell Biol., 22, 165–182.
20) Owen, I. & Shewmaker, F. (2019) The Role of Post-Translational Modifications in the Phase Transitions of Intrinsically Disordered Proteins. Int. J. Mol. Sci., 20, 5501.
21) Wippich, F., Bodenmiller, B., Trajkovska, M.G., Wanka, S., Aebersold, R., & Pelkmans, L. (2013) Dual specificity kinase DYRK3 couples stress granule condensation/dissolution to mTORC1 signaling. Cell, 152, 791–805.
22) Wang, J.T., Smith, J., Chen, B., Schmidt, H., Rasoloson, D., Paix, A., Lambrus, B.G., Calidas, D., Betzig, E., & Seydoux, G. (2014) Regulation of RNA granule dynamics by phosphorylation of serine-rich, intrinsically disordered proteins in C. elegans. eLife, 3, e04591.
23) Wang, A., Conicella, A.E., Schmidt, H.B., Martin, E.W., Rhoads, S.N., Reeb, A.N., Nourse, A., Montero, D.R., Ryan, V.H., Rohatgi, R., et al. (2018) A single N-terminal phosphomimic disrupts TDP-43 polymerization, phase separation, and RNA splicing. EMBO J., 37, e97452.
24) Rai, A.K., Chen, J.-X., Selbach, M., & Pelkmans, L. (2018) Kinase-controlled phase transition of membraneless organelles in mitosis. Nature, 559, 211–216.
25) Yamazaki, H., Takagi, M., Kosako, H., Hirano, T., & Yoshimura, S.H. (2022) Cell cycle-specific phase separation regulated by protein charge blockiness. Nat. Cell Biol., 24, 625–632.
26) Castelnovo, M. & Joanny, J.F. (2002) Phase Diagram of Diblock Polyampholyte Solutions. Macromol, 35, 4531–4538.
27) Lin, Y.-H. & Chan, H.S. (2017) Phase Separation and Single-Chain Compactness of Charged Disordered Proteins Are Strongly Correlated. Biophys. J., 112, 2043–2046.
28) Das, S., Eisen, A., Lin, Y.-H., & Chan, H.S. (2018) A Lattice Model of Charge-Pattern-Dependent Polyampholyte Phase Separation. J. Phys. Chem. B, 122, 5418–5431.
29) Lin, Y.-H., Song, J., Forman-Kay, J.D., & Chan, H.S. (2017) Random-phase-approximation theory for sequence-dependent, biologically functional liquid-liquid phase separation of intrinsically disordered proteins. J. Mol. Liq., 228, 176–193.
30) Ochoa, D., Jarnuczak, A.F., Viéitez, C., Gehre, M., Soucheray, M., Mateus, A., Kleefeldt, A.A., Hill, A., Garcia-Alonso, L., Stein, F., et al. (2020) The functional landscape of the human phosphoproteome. Nat. Biotechnol., 38, 365–373.
31) Needham, E.J., Hingst, J.R., Parker, B.L., Morrison, K.R., Yang, G., Onslev, J., Kristensen, J.M., Højlund, K., Ling, N.X.Y., Oakhill, J.S., et al. (2022) Personalized phosphoproteomics identifies functional signaling. Nat. Biotechnol., 40, 576–584.
32) Stoeger, T., Battich, N., & Pelkmans, L. (2016) Passive Noise Filtering by Cellular Compartmentalization. Cell, 164, 1151–1161.
33) Deviri, D. & Safran, S.A. (2021) Physical theory of biological noise buffering by multicomponent phase separation. Proc. Natl. Acad. Sci. USA, 118, e2100099118.
34) Hofweber, M., Hutten, S., Bourgeois, B., Spreitzer, E., Niedner-Boblenz, A., Schifferer, M., Ruepp, M.D., Simons, M., Niessing, D., Madl, T., et al. (2019) Phase Separation of FUS Is Suppressed by Its Nuclear Import Receptor and Arginine Methylation. Cell, 173, 706–719.
35) Gibson, B.A., Doolittle, L.K., Schneider, M.W.G., Jensen, L.E., Gamarra, N., Henry, L., Gerlich, D.W., Redding, S., & Rosen, M.K. (2019) Organization of Chromatin by Intrinsic and Regulated Phase Separation. Cell, 179, 470–484.
著者紹介Author Profile
 吉村 成弘(よしむら しげひろ)
吉村 成弘(よしむら しげひろ)京都大学大学院生命科学研究科 准教授.博士(人間・環境学).
略歴1974年兵庫県神戸市に生まれる.97年京都大学総合人間学部卒業,2002年同大学院人間・環境学研究科博士課程修了・学位取得.同年京都大学大学院生命科学研究科助手,03年同助教授を経て,2007年から現職.
研究テーマと抱負研究を始めた頃は,タンパク質の「かたち」と「機能」に魅了されて分子イメージング等に没頭していたが,いつの間にか「かたち」のないタンパク質の挙動と「機能」にどっぷりはまる.ものごとの原理をできるだけシンプルに説明したい.
ウェブサイトhttp://www.chrom.lif.kyoto-u.ac.jp/
YouTube Channelhttps://www.youtube.com/channel/UCysbeRypwlmNJ7nVOzHom3A
趣味ロードバイク,江戸,もののふ.