Neurexinは,1990年初頭に,α-Latrotoxinの受容体候補として結合親和性スクリーニングによりThomas C. Südhofらのグループによって単離された1).α-Latrotoxinは,セアカゴケグモ由来の神経毒で,シナプス前終末に作用してシナプス小胞を過剰に放出させ,神経伝達物質を枯渇させることによりシナプス機能を障害する.このため,Neurexinは発見当初よりシナプス前終末に局在していることを前提に研究が進められた.PC12細胞を用いたシナプス小胞の放出実験で,Neurexinは実際,α-Latrotoxinの受容体としての機能を有していることが証明された2).一方で,Neurexinは細胞外領域にLNSドメインを含む細胞接着因子としての構造を有していることから,その後はほとんどシナプス接着因子としての観点から研究が行われてきた.Neuroliginは,Neurexinのβアイソフォームの細胞外ドメインと結合する分子として単離された3).当初は,βアイソフォームのみに結合すると考えられていたが,その後,Neurexin, Neuroligin双方の選択的スプライス部位の挿入パターンの組合わせによって,αアイソフォームとも結合することが示された4).Neuroliginも細胞接着因子の構造を有していることから,シナプス前終末にNeurexinが局在しているのに対し,Neuroliginはシナプス後部に局在し,これらの結合がシナプス形成を誘導するとの仮説が立てられた.以下,ヒトの遺伝子名をすべて大文字表記,マウスの遺伝子名を最初の文字のみ大文字表記,タンパク質名を通称表記することで区別する.
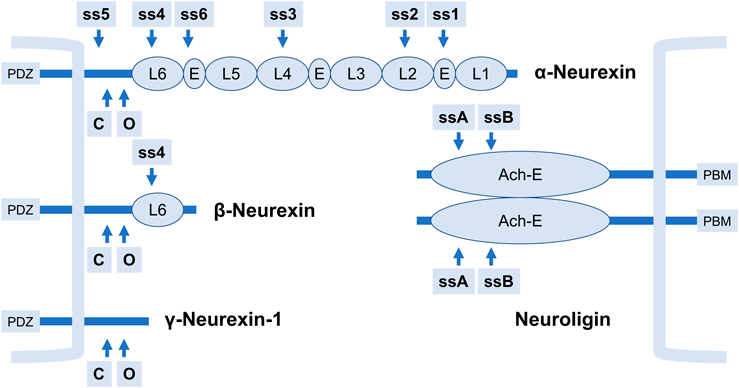
Neurexinには,NRXN1, NRXN2, NRXN3というきわめて相同性の高い三つの遺伝子が存在している.それぞれ2種類のプロモータによりαとβという2種類のアイソフォームが産生されると考えられていたが,NRXN1に関してはさらに別のプロモータによりγというもう1種類のアイソフォームも産生されることが判明している5, 6)(図1).γアイソフォームの機能に関してはあまり研究されていないため,今回の総説では詳しくふれない.α-Neurexinは,遺伝子の5′側にあるプロモータによって生産され,Neurexinタンパク質の主要なドメイン構造のすべてを含んでいる.一方,βプロモータは遺伝子の真ん中あたりにあるイントロン中に含まれ,β-Neurexinに特異的なごく短いβ-Neurexin翻訳開始点を含むエクソンの後は,α-Neurexinの途中から構造を共有している.Neurexinは1回膜貫通型タンパク質で,α-Neurexinは,細胞外領域に六つのLNSドメインと三つのEGF様リピートを有している(図1).最後のLNSドメインの後に糖鎖結合部位(O-linked glycosylation site)とcystein loopがあり,その後,膜貫通領域と短い細胞内領域が続く.細胞内領域のC末端には,PDZドメイン結合配列が存在する.β-Neurexinをコードする最初のエクソンは,α-Neruexinの最後の(3番目の)EGF様リピートをコードするエクソンと最後の(6番目の)LNSドメインをコードするエクソンとの間にあり,前述のβ-Neurexin特異的配列の後,最後の(6番目の)LNSドメインからC末端までをα-Neurexinと共有する構造になっている.Neurexinには五つの選択的スプライス部位(ss1~ss5)の存在が知られていたが,最近もう1か所の選択的スプライス部位(ss6)が見つかっている7).ss1~ss5は,NRXN1, NRXN2, NRXN3のすべての遺伝子に存在するが,ss6に関しては,NRXN1とNRXN3のみで見つかっており,NRXN2では存在が確認されていない.
Neurexinは,3種類の遺伝子,α, β, γというアイソフォームの存在,選択的スプライス部位の挿入パターンの組合わせにより,アイソフォームの数は全部で4000種類以上に及ぶ8).これら構造の微妙に異なるNeurexinアイソフォームが神経回路ごとに異なった発現様式で局在し,異なるリガンドとの結合特異性を有していることもわかってきている.リガンドとの結合特異性については,ss4の挿入の有無との関係が最もよく研究されている.ss4は,6番目のLNSドメイン内にあるため,α-Neurexinとβ-Neurexinの両方に存在している.これまでNeurexinの細胞外ドメインを介して結合する分子は数多く見つかっているが,大脳皮質や海馬での代表的な結合分子であるNeuroliginとLRRTMファミリータンパク質は,ss4の挿入がないものとの結合親和性が高い9–11).一方,小脳の平行線維–プルキンエ細胞間のシナプスでの分子であるCerebelinは,ss4の挿入があるものと特異的に結合する12).これらNeurexinの細胞外ドメインと結合するリガンドタンパク質は,互いに結合し,シナプス形成を誘導することが示されている.NeuroliginやLRRTMを発現させたCOS細胞またはHEK293細胞を分散ニューロン培養系に添加すると,これらの細胞の表面に共培養したニューロンの軸索末端がリクルートされて,接合部位にシナプス前終末の構造が形成される13, 14).この人工的に作られたシナプスの前終末ではNeurexinの集積が観察される.また,β-Neurexinの細胞外ドメインの組換えタンパク質を培養液に添付し,培養ニューロン末端で発現するNeurexinのリガンド結合を競合阻害すると,人工的シナプスの形成が阻害される13).小脳のプルキンエ細胞の樹状突起では,イオンチャネルとして機能しないグルタミン酸受容体であるGluD2が発現しているが,これが,顆粒細胞から分泌されるCerebelin-1(Cbln1)と結合し,小脳平行線維–プルキンエ細胞間のシナプス形成に関わっていることが発見された15).さらに,GluD2の細胞外領域をコートしたビーズを小脳の顆粒細胞と共培養した状態でクロスリンクし,GluD2に結合してシナプス形成に関わる分子をプルダウンで探索したところ,Cbln1とNeurexinが検出された.この研究により,平行線維の軸索末端に発現するNeurexinが,分泌タンパク質であるCbln1を介して,プルキンエ細胞のGluD2と三者結合し,平行線維–プルキンエ細胞間のシナプス形成を担っていることが示された12).Cerebelinに似た分子として,C1q-likeタンパク質があるが,Neurexinは海馬CA3領域でC1q-likeタンパク質とも結合し,カイニン酸受容体の機能を修飾していることも示されている16).
Neurexinの細胞内領域は,MAGUKファミリータンパク質であるCASKと結合している17).CASKはPDZドメインを有しており,NeurexinのPDZ結合配列を介して結合しているが,結合にはこの部位だけでは不十分で,さらに複数の領域を介して結合していると考えられている.CASKはN末端にCaMキナーゼドメインを有している.CASKのCaMキナーゼドメインは当初はキナーゼ活性がないと考えられていたが,後に,Mg2+の濃度が低い状態でNeurexinの細胞内にある複数のセリンをリン酸化することが確認されている18).CASKによるNeurexinのリン酸化の生理的意義は不明であるが,このリン酸化によって,CASK-Neurexin–Liprin-α複合体からLiprin-αが解離することが示されている19).
Neurexinの神経回路における機能は,ノックアウトマウスを用いた研究により示されている.α-Nrxnの翻訳開始点を含む三つのエクソンのそれぞれをノックアウトしたマウスのうち,Nrxn3αのシングルノックアウトマウスはマウス個体が成熟までに致死となる個体が一部みられるものの,Nrxn1αとNrxn2αのシングルノックアウトではほとんどの個体が成熟期まで生存する.Nrxn2αとNrxn3αのダブルノックアウトマウスは半数が成熟期までに致死となり,Nrxn1αとNrxn2αのダブルノックアウトマウスは大部分が成熟期までに致死となる.Nrxn1αとNrxn3αのダブルノックアウトマウスは生後数日でほとんどの個体が致死となり,Nrxn1α, Nrxn2α, Nrxn3αのトリプルノックアウトマウスは,生後24時間以内にほぼ全個体が呼吸不全により致死となる20).生直後マウスの脳幹スライスから呼吸中枢シナプス機能を電気生理学的に解析したところ,α-NeurexinのトリプルノックアウトではN-typeカルシウムチャネル性の応答が低下していることが示された20).
筆者らはβ-Nrxnのトリプルノックアウトマウスを作製し,解析を行った21).このマウスは,β-Nrxn特異的エクソンの両側のイントロンにloxPを挿入した,floxマウスとして作製した.生殖系列でCre組換え酵素を発現するマウスと交配して作製した3種類のβ-Nrxnのノックアウトマウスは,シングルノックアウトの状態では生存にも成長にもほとんど影響がみられなかった.いずれかの組合わせによるダブルノックアウトでもマウスは生存するが,次世代への交配が困難な状況であった.3種類の遺伝子すべてをノックアウトしたトリプルノックアウトマウスは,体重が低下し成長困難な状況もみられたが,成獣になるまで生存する個体も多く存在した21).β-Nrxnのトリプルfloxマウスの大脳皮質から作製した分散培養ニューロンにレンチウイルスでCre組換え酵素を導入してトリプルノックアウトの培養ニューロンを作製し,解析を行った.patch-clamp法によりシナプス機能を解析したところ,興奮性シナプス応答であるAMPA受容体性とNMDA受容体性のシナプス応答が低下していたのに対し,抑制性シナプス応答であるGABA受容体性応答に変化はみられなかった.カルシウムインジケータータンパク質であるGCaMP5Gとシナプス前終末タンパク質シナプトブレビン2とを融合した組換えタンパク質を発現するコンストラクト(GCaMP5G-Syb2)をβ-Nrxnのトリプルノックアウトニューロンに導入し,活性帯(active zone)でのカルシウムの流入を調べたところ,β-Nrxnのトリプルノックアウトニューロンでは活動電位に依存した活性帯でのカルシウムの流入が低下していることが判明した21).さらに,興奮性シナプス前終末に局在するエンドカンナビノイド受容体(CB1受容体)のアンタゴニスト(AM251)やアゴニスト(WIN55, 212-2),シナプス後部でのエンドカンナビノイドの産生を阻害する薬剤(U73122)を用いた実験により,β-Nrxnトリプルノックアウトでは,シナプス後部でのエンドカンナビノイド(2-AG)の産生が亢進し,シナプス間隙を乗り越えてシナプス後部から逆行性にシナプス前終末のCB1受容体に作用するエンドカンナビノイドが増加するため,CB1受容体シグナルによる活性帯の電位依存性カルシウムチャネル阻害作用が亢進して,シナプス小胞からの興奮性伝達物質の放出確率が低下しているという結論を得た21).β-Neurexinはシナプス前終末に局在していることから,このことはβ-Neurexinがトランスシナプティックにシナプス後部のエンドカンナビノイドの産生を抑制していることになるが,詳しいメカニズムについてはわかっていない.
前述のとおり,in vitroの研究でNeurexinの4番目のスプライス部位(ss4)は,リガンドとの結合特異性を規定していることが示されている.Neurexinのss4の挿入の有無を,マウスの脳領域ごとに分けて定量的PCRによって解析したところ,大脳皮質や海馬ではss4の挿入がないものが優位に発現しているのに対し,嗅球や小脳ではss4の挿入があるものが優位に発現していた.そして,この傾向は,3種類のNrxn遺伝子のうち,Nrxn3で特に顕著であった22).Neurexinのss4の挿入の有無が,脳神経回路機能にどのような役割を果たしているのかを解析するために,筆者らはNrxn3遺伝子のss4の挿入を人工的に操作したマウスを作製し解析を行った.Nrxn3遺伝子のss4をコードするエクソンのスプライス受容配列に変異を加えて典型的なスプライス受容配列に変換し,同時にこのエクソンの両端のイントロンにloxPを挿入したマウスを作製した.PCR解析により,このマウスは通常の状態で常にss4が含まれるNrxn3のみを発現し,Cre組換え酵素によりss4のエクソンを除去すると,ss4を含まないNrxn3のみを発現することが確認できた.patch-clamp法を用いた電気生理学的解析により,ss4を含むNrxn3のみを発現するマウスの海馬のニューロンでは,AMPA受容体性シナプス応答が選択的に低下し,NMDA受容体性やGABA受容体性応答に異常はみられなかった.一方,ss4を含まないNrxn3のみを発現するマウスでは,AMPA受容体性,NMDA受容体性,GABA受容体性応答のすべてに異常がみられなかった.このマウスの海馬分散培養ニューロンにおいて,AMPA受容体サブユニットであるGluA1の抗体を用いた表面標識実験により,ss4を含むNrxn3のみを発現するニューロンではGluA1のエンドサイトーシスが亢進し,シナプス膜表面の密度が低下している結果が得られた.ss4を含むマウスでみられるAMPA受容体性応答の低下は,ss4を含むNrxnの過剰発現でレスキューできなかったが,ss4を含まないNrxnではαでもβでも,さらには細胞内領域を欠いたコンストラクトでもレスキューできた.ss4を含むNeurexin-3は,NeurolignやLRRTMなどのシナプス後部タンパク質との結合親和性が低いことから,Neurexin-3は,シナプス後部リガンドとの結合を介して,トランスシナプティックにAMPA受容体のシナプス後膜表面への輸送を制御していることが示唆された22).
筆者らはNrxn3のコンディショナルノックアウトマウスも作製・解析を行った23).これは,Nrxn3のαとβの共通の第一エクソンの両側のイントロンにloxPを挿入したfloxマウスとして作製したもので,生殖系列でこのエクソンを除去したNrxn3ノックアウトマウスは完全致死とはならないが,野生型に比べて体重が低く,約半数が成熟期まで生存しなかった.Nrxn3ノックアウトマウスは,海馬のニューロンでは,前述のss4を含むもののみを発現するマウスと同様,AMPA受容体性シナプス応答が選択的に低下しており,培養ニューロンの実験でも,AMPA受容体のシナプス後膜への輸送の低下が認められた.このことから,やはり海馬においてNeurexin-3はトランスシナプティックなAMPA受容体機能の制御がシナプス機能をつかさどる上で重要な役割を担っていると考えられる.一方,嗅球の顆粒細胞のシナプスにおいては,AMPA受容体機能の異常は認められない反面,GABA受容体性シナプス応答の低下が認められた.これは,海馬とは異なりss4のみを発現するNrxn3のコンストラクトの導入によりレスキューできたが,細胞内領域を欠損したコンストラクトではレスキューできなかった.このことから,Neurexin-3は,脳の領域によって異なるメカニズムでシナプス機能を制御していることが示唆された23).
α, βの両方のアイソフォームを含むNeurexinの三つのすべての遺伝子をノックアウトしたマウスも作製された24).Neurexinの最後のエクソンは,三つの遺伝子とも膜貫通領域の少し前からC末端の終止コドン,3′ UTRを含んでいるため,このエクソンの前のイントロンと,3′ UTRの部分にloxPを挿入したマウスを作製し,Cre組換え酵素によりこの部位を除去すると,α, βともに細胞膜から外れた分泌型タンパク質しか産生されなくなり,シナプス接着因子としての機能を喪失する.生殖系列ですべてのNrxn遺伝子を除去したマウスは生直後までに致死となるため,領域特異的にCre組換え酵素を発現するマウスと交配することによるコンディショナルノックアウトでの解析を行った.小脳顆粒細胞特異的にCre組換え酵素を発現するマウス(GluN2C-Cre)と,このトリプルfloxマウスを交配し,小脳顆粒細胞特異的Nrxnトリプルノックアウトを作製すると,このマウスでは小脳顆粒細胞が細胞死を起こし,小脳低形成を呈した.Nrxnトリプルfloxマウスから作製した小脳顆粒細胞培養にレンチウイルスによってCre組換え酵素を導入すると,数日以内にほとんどの培養顆粒細胞が死滅した.ss4の挿入のあるタイプとないタイプのどちらのNeurexinを導入した場合でも,この顆粒細胞死はレスキューできたが,細胞内領域を欠いたものや別のものに置換したNeurexinコンストラクトではレスキューできなかった.レンチウイルスを用いた場合,ほとんどすべての培養顆粒細胞にCre組換え酵素が導入されるが,リポフェクションにより,培養顆粒細胞のうち,まばらにCre組換え酵素を導入した場合は,Cre組換え酵素が導入された顆粒細胞も死滅しなかった.さらに,野生型マウス由来の顆粒細胞を,Nrxnトリプルfloxマウス由来の顆粒細胞と混合して培養し,Cre組換え酵素によりノックアウトと野生型顆粒細胞を混在させた場合も,ノックアウト顆粒細胞は死滅しなかった.このことから,Nrxnトリプルノックアウトによる顆粒細胞死は,細胞非自律的(non-cell autonomous)なメカニズムによることが示唆された.一つの可能性として,Nrxnのトリプルノックアウトでは,顆粒細胞の生存に必要な神経栄養因子の分泌が欠損しているのではないかとの仮説が出てきた.このため,Nrxnトリプルノックアウト顆粒細胞培養にさまざまな神経栄養因子を添加したところ,BDNFを添加した場合に顆粒細胞死がレスキューされた.これらのことから,Nrxnのトリプルノックアウトの小脳顆粒細胞では,BDNFの放出不全が起こっており,細胞非自律的に顆粒細胞の生存を障害していることが示唆された24).これらNeurexinの遺伝子改変マウスの表現型を表1にまとめた.
表1 Neurexin遺伝子改変マウスの表現型| 系統 | 表現型 |
|---|
| α-Nrxn TKO | N-type Ca2+チャネル機能不全によるシナプス伝達の低下20) |
| β-Nrxn cTKO | 2-AGの産生亢進による興奮性シナプス伝達の低下21) |
| Nrxn3 ss4 KI/KO | ss4 KIでAMPA受容体のエンドサイトーシスの亢進22) |
| Nrxn3 cKO | 海馬でAMPA受容体機能の低下23) |
| 嗅球でGABA受容体機能の低下23) |
| Nrxn cTKO | BDNF放出不全による小脳顆粒細胞の細胞死の誘発24) |
| KO:knockout, KI:knockin, cKO:conditional knockout, TKO:triple knockout, cTKO:conditional triple knockout. |
Neuroliginは,β-Neurexinの細胞外ドメインと結合する分子として,生化学的に単離された3).Neuroliginは細胞外にアセチルコリンエステラーゼ様ドメインを有する1回膜貫通型タンパク質で,Neurexin同様短い細胞内領域のC末端にPDZ結合配列を有している(図1).Neuroliginには,ヒトではNLGN1, NGLN2, NLGN3, NLGN4X, NLGN4Yの5種類の遺伝子が存在するが,NLGN4X, NLGN4Yはいわゆる性染色体間相同遺伝子(gametologous gene)であるため,4種類と表現されることも多い.実際,マウスにおいて,Nlgn4XとNlgn4Yは偽常染色体領域に存在し,あたかも常染色体上の遺伝子のごとく振る舞い,実質同じ遺伝子である25).X染色体とY染色体は,もともと常染色体の一種だったものが,進化の過程で別の染色体に分離し,遺伝子がX, Y特異的なものへと変化するに伴い,Y染色体上の多くの遺伝子が偽遺伝子化(pseudogene)または消失していった.X, Y染色体特異的領域は進化の過程でどんどん広がり,偽常染色体領域を侵食していったが,偽常染色体領域は多くの種でわずかに残存しており,マウスではNlgn4X, Nlgn4Yはその領域内にある遺伝子ということになる.ヒトのNLGN4XとNLGN4Yは偽常染色体領域から分離している25, 26).Neuroligin-1, 2, 3は,ヒトとマウスでアミノ酸配列に高い保存性を有しているが,Neuroligin-4Xに関しては,ヒトとマウスで保存性は低く,発見当初はこれらが種間相同分子(ortholog)に相当するのかどうかが議論になった27).ヒトではNLGN4Xは,自閉症との相関が特に強い遺伝子として知られるが,マウスでは,Nlgn4Xは中枢神経系ではそれほど強く発現しておらず,シナプスにおける作用はNeuroligin-1, 2, 3が主流になっていると考えらえている28).
Neuroliginは当初,β-Neurexinのみと結合すると考えられていたが,α-Neurexinともスプライス部位の挿入パターンによって結合するものが存在することが判明している.Neuroliginのアセチルコリンエステラーゼ様ドメイン内には,ssA, ssBという2か所の選択的スプライス部位が存在する.ssBは,Neuroligin-1にのみ存在するが,このssBの挿入がないNeuroligin-1,またはもともとこのssBが存在しないNeuroligin-2, Neuroligin-3は,α-Neurexinのss4の挿入がないものとも結合することが示された4).
Neuroliginは,ホモ,またはヘテロ二量体を形成してシナプス後部に局在している29).Neuroligin-1は興奮性シナプス後部に局在し,PDZドメインを介してPSD-95と結合し,PSD複合体を形成している30).一方,Neuroligin-2は,抑制性シナプスに局在し,細胞内領域でGephyrinと結合し,GABA受容体機能を制御している31).Neuroligin-3は,興奮性,抑制性の両方に局在し,Neuroligin-3自身のホモ二量体に加え,興奮性シナプスではNeuroliign-1と,抑制性シナプスではNeuroligin-2とヘテロ二量体も形成している32).Neuroliginがシナプス形成に関わっていることに関しては,前述のとおり,Neuroliginを異所性発現させたCOS細胞やHEK293細胞と分散化したニューロンの共培養での人工シナプス形成実験によって証明された.また,Neuroliginを分散培養ニューロンに過剰発現するとシナプスの密度が増えるという結果もこの考えをサポートした33).一方,後述のNeuroliginのノックアウトマウスを用いた研究では,Neuroliginがない場合にシナプス機能は低下するが,シナプスの数はそれほど変化しないという結果が得られている.このことから,Neuroliginの生体内での機能はシナプス形成よりも,シナプスの成熟,機能的修飾が主ではないかと現在では考えられている.
Nlgn1, Nlgn2, Nlgn3のノックアウトマウスの作製はSüdhofと彼の研究室から独立したNilse Broseのグループによって進められたが,これら個別の系統の解析に先立って,Nlgn1, Nlgn2, Nlgn3のトリプルノックアウトマウスの解析が発表された28).Nlgnのトリプルノックアウトマウスは生直後に呼吸不全により致死となる.patch-clamp法を用いた電気生理により呼吸中枢でシナプス機能を解析すると,興奮性(グルタミン酸作動性),抑制性(GABA作動性)シナプスともに,シナプス応答の低下がみられた.Neurexin同様,Neuroliginはシナプスオーガナイザーの主役であると考えられていたため,Neuroliginの主要な三つの遺伝子をトリプルノックアウトすると,シナプス自体がなくなるのではないかとの期待もあった.しかし,Nlgnのトリプルノックアウトでも,抑制性シナプスの数が若干減る程度で,シナプス形成自体に顕著な異常はみられなかった28).前述のNrxnのトリプルノックアウトでもシナプスそのものは形成されるが,その論文が発表されたのはNlgnのトリプルノックアウトよりだいぶ後の話であるため,Nlgnのトリプルノックアウトマウスで得られた結果は,哺乳類においてシナプス形成のマスター遺伝子の存在に疑問を呈するものとなった.Nlgn1のシングルノックアウトマウスは,海馬CA1ニューロンのpatch-clamp法による解析で,NMDA受容体性シナプス応答の低下が認められたが,AMPA受容体性応答やGABA受容体性応答に変化はみられなかった34).一方で,Nlgn2のシングルノックアウトでは,GABA受容体性応答の低下がみられた34).Nlgn3のシングルノックアウトマウスについては大脳皮質や海馬で顕著な興奮性,抑制性シナプス機能の異常はみられないが,小脳の平行線維–プルキンエ細胞間のシナプスで,代謝型グルタミン受容体性(mGluR)の長期抑圧(LTD)の形成不全がみられたり35),腹側線条体や側坐核のD1受容体陽性中型有棘細胞(medium spiny neuron:MSN)に対するシナプス抑制の障害がみられるなど36),脳の領域によってさまざまな表現型が報告されている.Neuroliginの遺伝子改変マウスの表現型について,表2にまとめた.
表2 Neuroligin遺伝子改変マウスの表現型| 系統 | 表現型 |
|---|
| Nlgn1,2,3 TKO | 呼吸中枢のシナプスで興奮性,抑制性シナプス伝達の低下28) |
| Nlgn1 KO | 海馬CA1ニューロンでNMDA受容体性応答の低下34) |
| over grooming48) |
| Nlgn2 KO | 大脳皮質のニューロンでGABA受容体性応答の低下34) |
| 不安行動,痛みに対する感受性の増強,協調運動の障害50) |
| Nlgn3 KO | 小脳の平行線維–プルキンエ細胞間のシナプスで,mGluRの長期抑圧(LTD)の形成不全35) |
| 腹側線条体や側坐核のD1受容体陽性中型有棘細胞(MSN)に対するシナプス抑制の障害36) |
| ローターロッドで落下潜時の延長36) |
| Nlgn3 R451C KI | social interactionの障害,空間学習記憶能力の亢進,大脳皮質2/3層の錐体ニューロンでのGABA受容体性応答の亢進41) |
| 海馬でGluN2Bの発現上昇とLTPの増強42) |
| mPFCのPV(+)ニューロンでのγオシレーションが減弱44) |
| ローターロッドで落下潜時の延長36) |
| Nlgn3 R704C KI | 海馬CA1領域でAMPA受容体性応答の低下46) |
| Nlgn4X KO | 社会性の異常,超音波発生の低下,脳のサイズが低下47) |
| KO:knockout, KI:knockin, TKO:triple knockout. |
自閉症は,社会性の障害,コミュニケーションの障害,限局した興味と繰り返し行動を特徴とする神経発達障害で,2~3歳ごろまでにこれらの症状の出現によって診断される.その原因について,一部環境要因の関与も指摘されているが,根本的には遺伝学的異常による先天的脳機能障害だと考えられている.2003年,Thomas Bourgeronが率いるフランスのグループが,スウェーデンのX連鎖性自閉症家系の遺伝子解析から,NLGN3のミスセンス変異(R451C)とNLGN4Xのストップコドン変異(D396X)を発見した37).これまで,自閉症との関連が示唆される染色体領域や,自閉症様症状を合併する症候群の原因遺伝子,ノックアウトマウスが発達障害様の表現型を示すなどの報告はあったが,非症候群性自閉症患者からの具体的な遺伝子変異を発見したという報告はこれが初めてだった.変異が発見されたのがNLGN3, NLGN4Xという両方ともNLGNファミリー遺伝子だったこと,これらがシナプス関連遺伝子だったことから,自閉症の原因としてシナプス機能の異常が関与しているのではないかとの仮説が浮上した.
NLGN3のR451C変異では,451番目の保存されたアルギニンがシステインに置換されており,これがNeuroligin-3タンパク質のミスフォールディングを起こし,小胞体(ER)に蓄積される38).R451C変異はNeurexinとの結合ドメインであるアセチルコリンエステラーゼ様ドメイン内にあるが,R451C変異を有するNeuroligin-3は,Neurexinとの結合能は保たれている39, 40).筆者らはこの変異が本当に自閉症を引き起こすのかを確認するため,この変異を有するノックインマウスを作製した41).このマウスは,ケージに閉じ込めた初対面のマウスに対する接触時間が,野生型コントロールに比べて少なかった.また,三つの区画を設けて箱の一方の端の区画に空のケージを,それとは反対側の区画にケージに閉じ込めた初対面のマウスを設置し,R451Cノックインマウスがどちらにどれだけ接触するかを調べた実験(3-chamber test)で,初対面のマウスに対する接触時間が,野生型コントロールマウスでみられるものと比較して低下していた41).これらのことから,NLGN3 R451Cマウスは,社会的相互作用(social interaction)が障害されていることが判明した.自閉症患者では知的障害を合併するケースも多い.このため,モリス水迷路試験でNlgn3 R451Cマウスの学習記憶能力を解析したところ,意外にもこのマウスでは野生型コントロールマウスに比べて学習記憶能力が亢進していた41).興味深いことに,自閉症患者では,特定の物事に対して驚異的な記憶能力を示すケースがよく知られている.これをサバン症候群と呼ぶが,この結果は,こうした能力を反映している可能性がある.Nlgn3 R451Cマウスの大脳皮質におけるシナプス機能をpatch-clamp法により解析したところ,体性感覚野の2/3層の錐体ニューロンに投射する抑制性シナプスの伝達強度が増強している結果が得られた41).これが,行動異常と関係しているのかについては解明されていない.Nlgn3 R451Cマウスの海馬CA1領域に投射するシャファー側枝を電気刺激し,CA1の錐体ニューロンの樹状突起が存在する放線状層(stratum radiatum)から細胞外電気記録を採取したところ,野生型コントロールマウスに比べて興奮性シナプス後電位(fEPSP)が上昇し,高頻度刺激によって誘発される長期増強(LTP)も増強していた42).さらに,patch-clamp法によりCA1錐体ニューロンへ投射するシナプス伝達の電気的応答の解析から,NMDA受容体性応答の漸減時間が延長していた42).これはNMDA受容体を構成するサブユニットのうち,GluN2Bが優位になったときにみられる現象である.GluN2Bの開口依存的阻害剤であるifenprodilに対する阻害効果もNlgn3 R451Cマウスで増強し,さらに海馬組織のホモジェネートからの定量的ウェスタンブロットで,GluN2Bタンパク質の発現量も増加していた42).GluN2Bを過剰発現したマウスでは学習記憶能力が増強することが知られることから43),このマウスでの学習記憶能力が亢進しているのは,海馬でのGluN2Bの発現が増強していることに起因すると考えられる.Nlgn3 R451Cマウスの内側前頭前皮質(mPFC)において,Parvalbumin陽性介在ニューロン(電気生理学的にfast-spiking interneuronとも呼ぶ)の興奮頻度が低下し,結果としてγオシレーションが減弱していることが判明した.光遺伝学的にParvalbumin陽性介在ニューロンを周期的に刺激してγオシレーションを誘発すると,社会性の異常が改善される結果が得られた44).このことから,Nlgn3 R451Cでみられる社会性の異常は,内側前頭前皮質の神経回路機能の異常に起因する可能性が強まった.
自閉症患者から発見されたNLGNの変異のほとんどは,細胞外のアセチルコリンエステラーゼ様ドメイン内にあるが,NLGN4XのR704C変異は,細胞内領域から発見された当時としては唯一の変異だった45).筆者は,この変異を有するノックインマウスを作製したが,作製開始時点ではマウスのNlgn4X遺伝子は発見されていなかったため,この変異をNlgn3の対応する配列に導入して作製した46).R451C変異と異なり,このマウスの海馬のCA1領域の錐体ニューロンに投射するシャファー側枝の電気刺激に対する細胞外記録の応答で,シナプス後電位(fEPSP)の低下がみられたが,長期増強に変化はみられなかった.patch-clamp法によりCA1領域の錐体ニューロンに投射するシナプス伝達の解析をしたところ,AMPA受容体性シナプス伝達が低下していたが,NMDA受容体性シナプス伝達や,GABA受容体性シナプス伝達に異常はみられなかった46).このマウスの行動解析の結果はまだ論文に発表されていない.
Nlgn3 R451CマウスやNlgn3 R704Cマウスの電気生理学的表現型はNlgn3ノックアウトマウスのものと異なることから,これらは機能獲得型(gain of function)変異だと考えられる.行動学的にも,Nlgn3ノックアウトマウスでは,社会行動の異常はみられない.一方,ローターロッドを用いた試験でNlgn3 R451CマウスとNlgn3ノックアウトマウスを比較すると,両者ともに野生型コントロールに比べてローターロッドから落下するまでの時間が延長している結果が得られている36).これらは,自閉症に関連したこだわり行動が強まったことに起因すると解釈されている.
2003年にBourgeronのグループで自閉症患者からNLGN3とNLGN4Xの遺伝子変異を発見した中心メンバー(論文の筆頭著者)であるStephane Jamainは,その後Broseのラボへ移り,Nlgn4Xのノックアウトマウスの仕事に携わり,行動解析の論文を筆頭著者として発表した.このマウスも,オープンフィールドや3-chamber試験で社会性の異常を呈し,超音波で検出できる発声(ultrasonic vocalization)の頻度も低下していた.また,MRIにより,大脳,小脳,脳幹のサイズが低下している結果が得られた47).
Nlgn1ノックアウトマウスは,過剰な毛繕い(over grooming)の表現型を示した.この表現型は,自閉症の症状であるこだわりや反復行動の指標と考えられている.Nlgn1ノックアウトマウスではNMDA受容体機能が低下しているが,NMDA受容体のco-agonistであるD-セリンを投与すると,過剰な毛繕いが改善されたことから,NMDA受容体機能の低下が過剰な毛繕いの原因だと考えられる48).一方,Nlgn1ノックアウトマウスでは,社会行動の異常は軽度であった48).自閉症変異であるP89Lを導入したNlgn1ノックインマウスでは,軽度であるが,社会嗜好性と社会的優位性の低下が認められた49).
Nlgn2ノックアウトマウスは,不安行動,痛みに対する感受性の増強,協調運動の障害がみられたが,社会行動の異常はみられなかった50).
自閉症との関連では,Neuroliginの方が先に注目を浴びたが,今となってはNeurexinも自閉症との関連が強い遺伝子として認識されている.Neurexinの遺伝子はすべて常染色体上にあるのに対して,Neuroliginの場合,Nlgn3とNlgn4XはX染色体に遺伝子があるため,遺伝子変異があると症状として出やすいのだと思われる.数学者でありヘッジファンドマネージャーでもあるジェームズ・サイモンズと,彼の妻マリリンが立ち上げたサイモンズ財団は,Simons Foundation Autism Research Initiative(頭文字とをってSFARIと呼ばれる)という自閉症研究事業も大きな活動の一つにしており,この財団が作成している自閉症関連遺伝子のデータベース(SFARI GENE)は自閉症研究者の間で参照されている.このデータベースでは,世に出た文献を収集して,自閉症との関連度合いをスコア化しているのだが(数が小さい方がより自閉症との関連が強い),NRXNは三つの遺伝子ともスコアが1である(表3).この中でも特に,NRXN1は自閉症との関連が強いことが,さまざまな遺伝子解析から明らかとなってきている51–55).Neurexinは,自閉症もさることながら,統合失調症や知的障害や神経変性疾患など,より広い精神神経疾患でも関連が指摘されることや,遺伝子の構造が複雑なため,ノックアウトマウスに対して行動解析がなされているが,厳密な意味で自閉症のモデルとして評価できるかは微妙なところである.
表3 NeurexinとNeuroliginの遺伝子情報とSFARIスコア| 遺伝子名 | タンパク質名 | 遺伝子座 | SFARIスコア |
|---|
| NRXN1 | Neurexin-1 | 2p16.3 | 1 |
| NRXN2 | Neurexin-2 | 11q13.1 | 1 |
| NRXN3 | Neurexin-3 | 14q24.3-q31.1 | 1 |
| NLGN1 | Neuroligin-1 | 3q26.31 | 2 |
| NLGN2 | Neuroligin-2 | 17p13.1 | 1 |
| NLGN3 | Neuroligin-3 | Xq13.1 | 1 |
| NLGN4X | Neuroligin-4X | Xp22.32-p22.31 | 1 |
| NLGN4Y | Neuroligin-4Y | Yq11.221 | 2 |
| SFARIスコアは1~5の5段階評価で,数字が小さいほど自閉症との関連が高い. |
6. Neurexin–Neuroliginと自閉症との関係に関する考察
非症候群性自閉症の多くは,多遺伝子性疾患(polygenic disorder)であると考えられており,単一遺伝子の異常により起こるケース(monogenic)は一部である.自閉症患者で見つかった遺伝子異常が,単独で自閉症を引き起こしていることを証明するのは難しく,Neurexin, Neuroliginについても同様である.実際,Neurexinについては,NRXN1をコードする領域のほぼ全体を欠失している健常者も存在している.NLGN3については,自閉症モデルとして確立しているR451Cは,レアヴァリアント(rare variat)でかつ機能獲得型変異なため,NLGN3遺伝子の異常が自閉症発症に必要十分条件であることを保証するわけではない.一方,Neurexin, Neuroliginともに,自閉症のリスク遺伝子としてリスク度合いがきわめて高い部類にあることは間違いない.これらリスク度合いの高い遺伝子異常に,中等度,または軽度のリスク遺伝子の変異や遺伝的多型(polymorphism)が複数組み合わさり,場合によっては環境要因も加味され,リスクの閾値を超えると自閉症の発症に至るのが実際のところだと思われる.Neurexin, Neuroliginにとどまらず,シナプス機能に関係する遺伝子の異常が自閉症患者から高頻度で見つかっていることからしても,脳の神経回路におけるシナプス機能の異常が自閉症発症の病態原理と深い関係があるのは間違いないと考えられる.
謝辞Acknowledgments
本稿執筆にあたっては,信州大学の白井良憲先生,森琢磨先生,鈴木絵美先生,大橋信彦先生,植村健先生および,分子細胞生理学教室のすべてのメンバーに感謝の意を申し上げる.
引用文献References
1) Ushkaryov, Y.A., Petrenko, A.G., Geppert, M., & Südhof, T.C. (1992) Neurexins: Synaptic cell surface proteins related to the alpha-latrotoxin receptor and laminin. Science, 257, 50–56.
2) Sugita, S., Khvochtev, M., & Südhof, T.C. (1999) Neurexins are functional alpha-latrotoxin receptors. Neuron, 22, 489–496.
3) Ichtchenko, K., Hata, Y., Nguyen, T., Ullrich, B., Missler, M., Moomaw, C., & Sudhof, T.C. (1995) Neuroligin 1: A splice site-specific ligand for beta-neurexins. Cell, 81, 435–443.
4) Boucard, A.A., Chubykin, A.A., Comoletti, D., Taylor, P., & Sudhof, T.C. (2005) A splice code for trans-synaptic cell adhesion mediated by binding of neuroligin 1 to alpha- and beta-neurexins. Neuron, 48, 229–236.
5) Yan, Q., Weyn-Vanhentenryck, S.M., Wu, J., Sloan, S.A., Zhang, Y., Chen, K., Wu, J.Q., Barres, B.A., & Zhang, C. (2015) Systematic discovery of regulated and conserved alternative exons in the mammalian brain reveals NMD modulating chromatin regulators. Proc. Natl. Acad. Sci. USA, 112, 3445–3450.
6) Sterky, F.H., Trotter, J.H., Lee, S.J., Recktenwald, C.V., Du, X., Zhou, B., Zhou, P., Schwenk, J., Fakler, B., & Sudhof, T.C. (2017) Carbonic anhydrase-related protein CA10 is an evolutionarily conserved pan-neurexin ligand. Proc. Natl. Acad. Sci. USA, 114, E1253–e1262.
7) Treutlein, B., Gokce, O., Quake, S.R., & Sudhof, T.C. (2014) Cartography of neurexin alternative splicing mapped by single-molecule long-read mRNA sequencing. Proc. Natl. Acad. Sci. USA, 111, E1291–E1299.
8) Tabuchi, K. & Sudhof, T.C. (2002) Structure and evolution of neurexin genes: Insight into the mechanism of alternative splicing. Genomics, 79, 849–859.
9) Sudhof, T.C. (2017) Synaptic neurexin complexes: A molecular code for the logic of neural circuits. Cell, 171, 745–769.
10) Cao, X. & Tabuchi, K. (2017) Functions of synapse adhesion molecules neurexin/neuroligins and neurodevelopmental disorders. Neurosci. Res., 116, 3–9.
11) Kasem, E., Kurihara, T., & Tabuchi, K. (2018) Neurexins and neuropsychiatric disorders. Neurosci. Res., 127, 53–60.
12) Uemura, T., Lee, S.J., Yasumura, M., Takeuchi, T., Yoshida, T., Ra, M., Taguchi, R., Sakimura, K., & Mishina, M. (2010) Trans-synaptic interaction of GluRdelta2 and Neurexin through Cbln1 mediates synapse formation in the cerebellum. Cell, 141, 1068–1079.
13) Scheiffele, P., Fan, J., Choih, J., Fetter, R., & Serafini, T. (2000) Neuroligin expressed in nonneuronal cells triggers presynaptic development in contacting axons. Cell, 101, 657–669.
14) Ko, J., Fuccillo, M.V., Malenka, R.C., & Sudhof, T.C. (2009) LRRTM2 functions as a neurexin ligand in promoting excitatory synapse formation. Neuron, 64, 791–798.
15) Matsuda, K., Miura, E., Miyazaki, T., Kakegawa, W., Emi, K., Narumi, S., Fukazawa, Y., Ito-Ishida, A., Kondo, T., Shigemoto, R., et al. (2010) Cbln1 is a ligand for an orphan glutamate receptor delta2, a bidirectional synapse organizer. Science, 328, 363–368.
16) Matsuda, K., Budisantoso, T., Mitakidis, N., Sugaya, Y., Miura, E., Kakegawa, W., Yamasaki, M., Konno, K., Uchigashima, M., Abe, M., et al. (2016) Transsynaptic modulation of kainate receptor functions by C1q-like proteins. Neuron, 90, 752–767.
17) Hata, Y., Butz, S., & Sudhof, T.C. (1996) CASK: A novel dlg/PSD95 homolog with an N-terminal calmodulin-dependent protein kinase domain identified by interaction with neurexins. J. Neurosci., 16, 2488–2494.
18) Mukherjee, K., Sharma, M., Urlaub, H., Bourenkov, G.P., Jahn, R., Sudhof, T.C., & Wahl, M.C. (2008) CASK functions as a Mg2+-independent neurexin kinase. Cell, 133, 328–339.
19) LaConte, L.E., Chavan, V., Liang, C., Willis, J., Schonhense, E.M., Schoch, S., & Mukherjee, K. (2016). Cell. Mol. Life Sci., 73(18), 3599–3621.
20) Missler, M., Zhang, W., Rohlmann, A., Kattenstroth, G., Hammer, R.E., Gottmann, K., & Sudhof, T.C. (2003) Alpha-neurexins couple Ca2+ channels to synaptic vesicle exocytosis. Nature, 423, 939–948.
21) Anderson, G.R., Aoto, J., Tabuchi, K., Foldy, C., Covy, J., Yee, A.X., Wu, D., Lee, S.J., Chen, L., Malenka, R.C., et al. (2015) β-Neurexins control neural circuits by regulating synaptic endocannabinoid signaling. Cell, 162, 593–606.
22) Aoto, J., Martinelli, D.C., Malenka, R.C., Tabuchi, K., & Sudhof, T.C. (2013) Presynaptic neurexin-3 alternative splicing trans-synaptically controls postsynaptic AMPA receptor trafficking. Cell, 154, 75–88.
23) Aoto, J., Foldy, C., Ilcus, S.M., Tabuchi, K., & Sudhof, T.C. (2015) Distinct circuit-dependent functions of presynaptic neurexin-3 at GABAergic and glutamatergic synapses. Nat. Neurosci., 18, 997–1007.
24) Uemura, T., Suzuki-Kouyama, E., Kawase, S., Kurihara, T., Yasumura, M., Yoshida, T., Fukai, S., Yamazaki, M., Fei, P., Abe, M., et al. (2022) Neurexins play a crucial role in cerebellar granule cell survival by organizing autocrine machinery for neurotrophins. Cell Rep., 39, 110624.
25) Maxeiner, S., Benseler, F., Krasteva-Christ, G., Brose, N., & Sudhof, T.C. (2020) Evolution of the autism-associated Neuroligin-4 gene reveals broad erosion of pseudoautosomal regions in rodents. Mol. Biol. Evol., 37, 1243–1258.
26) Maxeiner, S., Benseler, F., Brose, N., & Krasteva-Christ, G. (2022) Of humans and gerbils- independent diversification of Neuroligin-4 Into X- and Y-specific genes in primates and rodents. Front. Mol. Neurosci., 15, 838262.
27) Bolliger, M.F., Pei, J., Maxeiner, S., Boucard, A.A., Grishin, N.V., & Sudhof, T.C. (2008) Unusually rapid evolution of Neuroligin-4 in mice. Proc. Natl. Acad. Sci. USA, 105, 6421–6426.
28) Varoqueaux, F., Aramuni, G., Rawson, R.L., Mohrmann, R., Missler, M., Gottmann, K., Zhang, W., Sudhof, T.C., & Brose, N. (2006) Neuroligins determine synapse maturation and function. Neuron, 51, 741–754.
29) Arac, D., Boucard, A.A., Ozkan, E., Strop, P., Newell, E., Sudhof, T.C., & Brunger, A.T. (2007) Structures of neuroligin-1 and the neuroligin-1/neurexin-1 beta complex reveal specific protein-protein and protein-Ca2+ interactions. Neuron, 56, 992–1003.
30) Irie, M., Hata, Y., Takeuchi, M., Ichtchenko, K., Toyoda, A., Hirao, K., Takai, Y., Rosahl, T.W., & Südhof, T.C. (1997) Binding of neuroligins to PSD-95. Science, 277, 1511–1515.
31) Varoqueaux, F., Jamain, S., & Brose, N. (2004) Neuroligin 2 is exclusively localized to inhibitory synapses. Eur. J. Cell Biol., 83, 449–456.
32) Budreck, E.C. & Scheiffele, P. (2007) Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. Eur. J. Neurosci., 26, 1738–1748.
33) Chih, B., Engelman, H., & Scheiffele, P. (2005) Control of excitatory and inhibitory synapse formation by neuroligins. Science, 307, 1324–1328.
34) Chubykin, A.A., Atasoy, D., Etherton, M.R., Brose, N., Kavalali, E.T., Gibson, J.R., & Sudhof, T.C. (2007) Activity-dependent validation of excitatory versus inhibitory synapses by neuroligin-1 versus neuroligin-2. Neuron, 54, 919–931.
35) Baudouin, S.J., Gaudias, J., Gerharz, S., Hatstatt, L., Zhou, K., Punnakkal, P., Tanaka, K.F., Spooren, W., Hen, R., De Zeeuw, C.I., et al. (2012) Shared synaptic pathophysiology in syndromic and nonsyndromic rodent models of autism. Science, 338, 128–132.
36) Rothwell, P.E., Fuccillo, M.V., Maxeiner, S., Hayton, S.J., Gokce, O., Lim, B.K., Fowler, S.C., Malenka, R.C., & Sudhof, T.C. (2014) Autism-associated neuroligin-3 mutations commonly impair striatal circuits to boost repetitive behaviors. Cell, 158, 198–212.
37) Jamain, S., Quach, H., Betancur, C., Rastam, M., Colineaux, C., Gillberg, I.C., Soderstrom, H., Giros, B., Leboyer, M., Gillberg, C., et al.; Paris Autism Research International Sibpair Study (2003) Mutations of the X-linked genes encoding neuroligins NLGN3 and NLGN4 are associated with autism. Nat. Genet., 34, 27–29.
38) Comoletti, D., De Jaco, A., Jennings, L.L., Flynn, R.E., Gaietta, G., Tsigelny, I., Ellisman, M.H., & Taylor, P. (2004) The Arg451Cys-neuroligin-3 mutation associated with autism reveals a defect in protein processing. J. Neurosci., 24, 4889–4893.
39) De Jaco, A., Comoletti, D., Kovarik, Z., Gaietta, G., Radic, Z., Lockridge, O., Ellisman, M.H., & Taylor, P. (2006) A mutation linked with autism reveals a common mechanism of endoplasmic reticulum retention for the alpha,beta-hydrolase fold protein family. J. Biol. Chem., 281, 9667–9676.
40) Fabrichny, I.P., Leone, P., Sulzenbacher, G., Comoletti, D., Miller, M.T., Taylor, P., Bourne, Y., & Marchot, P. (2007) Structural analysis of the synaptic protein neuroligin and its beta-neurexin complex: determinants for folding and cell adhesion. Neuron, 56, 979–991.
41) Tabuchi, K., Blundell, J., Etherton, M.R., Hammer, R.E., Liu, X., Powell, C.M., & Sudhof, T.C. (2007) A neuroligin-3 mutation implicated in autism increases inhibitory synaptic transmission in mice. Science, 318, 71–76.
42) Etherton, M., Foldy, C., Sharma, M., Tabuchi, K., Liu, X., Shamloo, M., Malenka, R.C., & Sudhof, T.C. (2011) Autism-linked neuroligin-3 R451C mutation differentially alters hippocampal and cortical synaptic function. Proc. Natl. Acad. Sci. USA, 108, 13764–13769.
43) Tang, Y.P., Shimizu, E., Dube, G.R., Rampon, C., Kerchner, G.A., Zhuo, M., Liu, G., & Tsien, J.Z. (1999) Genetic enhancement of learning and memory in mice. Nature, 401, 63–69.
44) Cao, W., Lin, S., Xia, Q.Q., Du, Y.L., Yang, Q., Zhang, M.Y., Lu, Y.Q., Xu, J., Duan, S.M., Jun, X., et al. (2018). Neuron, 97(6), 1394.
45) Yan, J., Oliveira, G., Coutinho, A., Yang, C., Feng, J., Katz, C., Sram, J., Bockholt, A., Jones, I.R., Craddock, N., et al. (2005) Analysis of the neuroligin 3 and 4 genes in autism and other neuropsychiatric patients. Mol. Psychiatry, 10, 329–332.
46) Etherton, M.R., Tabuchi, K., Sharma, M., Ko, J., & Sudhof, T.C. (2011) An autism-associated point mutation in the neuroligin cytoplasmic tail selectively impairs AMPA receptor-mediated synaptic transmission in hippocampus. EMBO J., 30, 2908–2919.
47) Jamain, S., Radyushkin, K., Hammerschmidt, K., Granon, S., Boretius, S., Varoqueaux, F., Ramanantsoa, N., Gallego, J., Ronnenberg, A., Winter, D., et al. (2008) Reduced social interaction and ultrasonic communication in a mouse model of monogenic heritable autism. Proc. Natl. Acad. Sci. USA, 105, 1710–1715.
48) Blundell, J., Blaiss, C.A., Etherton, M.R., Espinosa, F., Tabuchi, K., Walz, C., Bolliger, M.F., Sudhof, T.C., & Powell, C.M. (2010) Neuroligin-1 deletion results in impaired spatial memory and increased repetitive behavior. J. Neurosci., 30, 2115–2129.
49) Nakanishi, M., Nomura, J., Ji, X., Tamada, K., Arai, T., Takahashi, E., Bucan, M., & Takumi, T. (2017) Functional significance of rare neuroligin 1 variants found in autism. PLoS Genet., 13, e1006940.
50) Blundell, J., Tabuchi, K., Bolliger, M.F., Blaiss, C.A., Brose, N., Liu, X., Sudhof, T.C., & Powell, C.M. (2009) Increased anxiety-like behavior in mice lacking the inhibitory synapse cell adhesion molecule neuroligin 2. Genes Brain Behav., 8, 114–126.
51) Levy, D., Ronemus, M., Yamrom, B., Lee, Y.H., Leotta, A., Kendall, J., Marks, S., Lakshmi, B., Pai, D., Ye, K., et al. (2011) Rare de novo and transmitted copy-number variation in autistic spectrum disorders. Neuron, 70, 886–897.
52) Sanders, S.J., Ercan-Sencicek, A.G., Hus, V., Luo, R., Murtha, M.T., Moreno-De-Luca, D., Chu, S.H., Moreau, M.P., Gupta, A.R., Thomson, S.A., et al. (2011) Multiple recurrent de novo CNVs, including duplications of the 7q11.23 Williams syndrome region, are strongly associated with autism. Neuron, 70, 863–885.
53) Liu, Y., Hu, Z., Xun, G., Peng, Y., Lu, L., Xu, X., Xiong, Z., Xia, L., Liu, D., Li, W., et al. (2012) Mutation analysis of the NRXN1 gene in a Chinese autism cohort. J. Psychiatr. Res., 46, 630–634.
54) Girirajan, S., Dennis, M.Y., Baker, C., Malig, M., Coe, B.P., Campbell, C.D., Mark, K., Vu, T.H., Alkan, C., Cheng, Z., et al. (2013) Refinement and discovery of new hotspots of copy-number variation associated with autism spectrum disorder. Am. J. Hum. Genet., 92, 221–237.
55) Sanders, S.J., He, X., Willsey, A.J., Ercan-Sencicek, A.G., Samocha, K.E., Cicek, A.E., Murtha, M.T., Bal, V.H., Bishop, S.L., Dong, S., et al.; Autism Sequencing Consortium. (2015) Insights into autism spectrum disorder genomic architecture and biology from 71 Risk Loci. Neuron, 87, 1215–1233.
著者紹介Author Profile
 田渕 克彦(たぶち かつひこ)
田渕 克彦(たぶち かつひこ)信州大学先鋭領域融合研究群バイオメディカル研究所・学術研究院医学系分子細胞生理学教室教授.博士(医学).
略歴1995年筑波大学医学専門学群卒業.1999年大阪大学大学院博士課程医学研究科修了.1999~2009年テキサス大学サウスウェスタンメディカルセンターおよびスタンフォード大学でThomas C. Südhof博士のもとへ留学.2009~2012年自然科学研究機構生理学研究所准教授を経て2012年から現職.
研究テーマと抱負神経発達障害を引き起こす脳神経回路メカニズムの解明を目指し,遺伝子改変動物モデルを用いて研究を行っている.同時に,これらの症状を改善するための研究も行っており,治療法の開発につながればと考えている.
ウェブサイトhttp://www.shinshu-u.ac.jp/faculty/medicine/chair/i-2seiri/ja/tabuchi.html