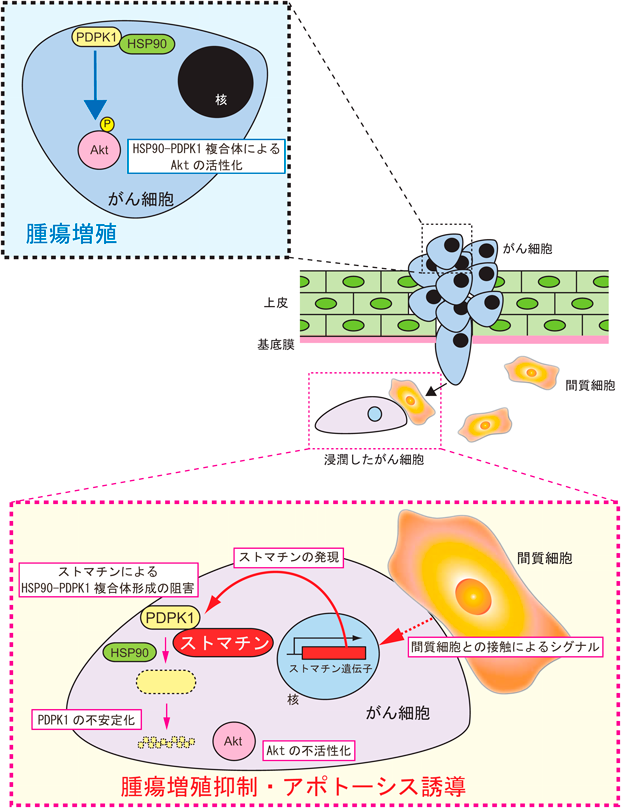
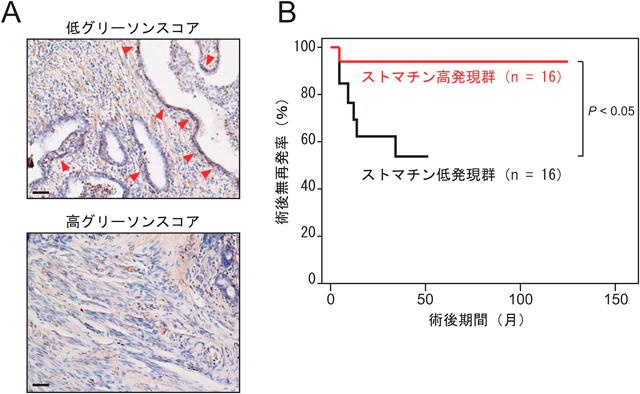
間質細胞との異種細胞間接触によりがん細胞に高発現するストマチンの腫瘍抑制作用Tumor suppressive effect of stomain on cancer cells contacted to stromal cells
滋賀医科大学生化学・分子生物学講座分子病態生化学部門Division of Molecular Medical Biochemistry, Department of Biochemistry and Molecular Biology, Shiga University of Medical Science ◇ 〒520–2192 滋賀県大津市瀬田月輪町 ◇ Seta Tsukinowa-cho, Otsu, Shiga 520–2192, Japan