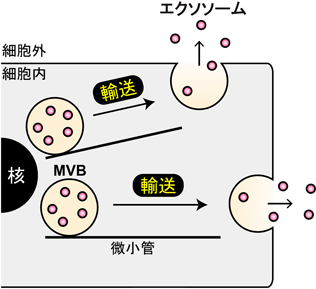
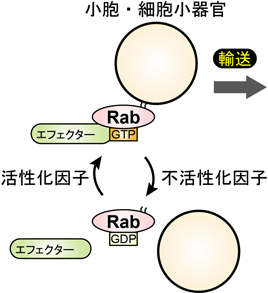
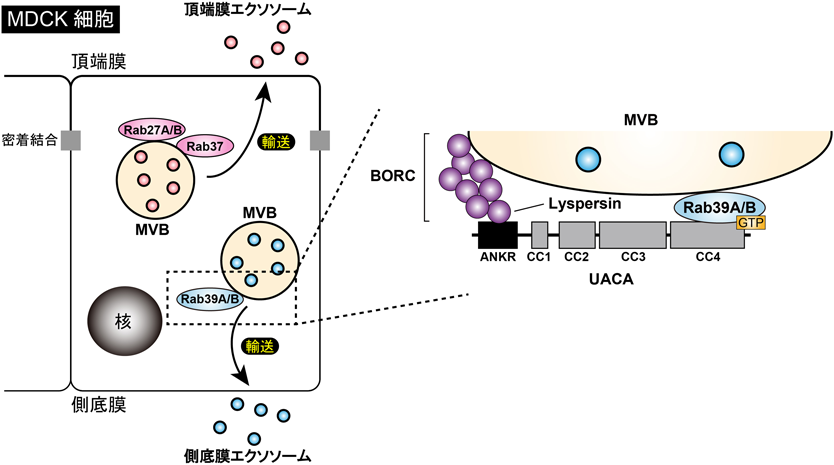
エクソソーム分泌を制御する細胞内分子基盤Intracellular molecular mechanisms of exosome release
東北大学大学院生命科学研究科膜輸送機構解析分野Laboratory of Membrane Trafficking Mechanisms, Department of Integrative Life Sciences, Graduate School of Life Sciences, Tohoku University ◇ 〒980–8578 宮城県仙台市青葉区荒巻字青葉6–3 理学研究科合同A棟10階1015 ◇ Aoba 6–3, Aoba-ku, Sendai, Miyagi, 980–8578, Japan