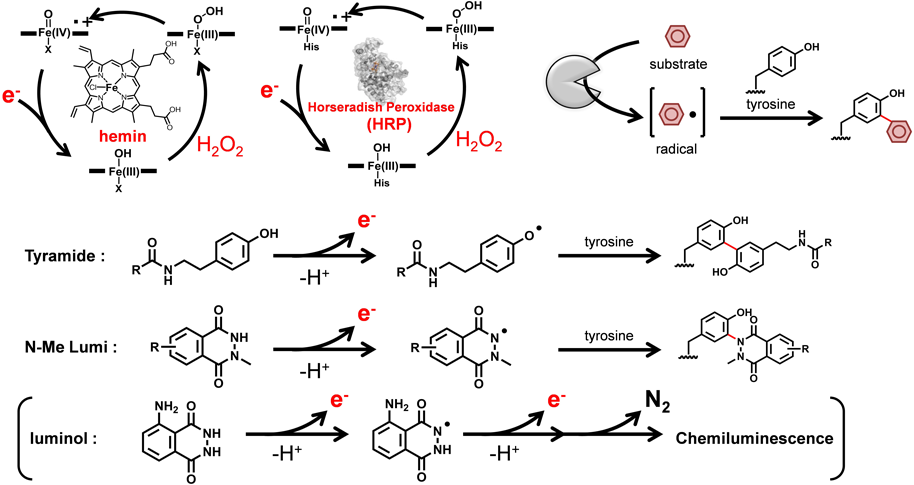
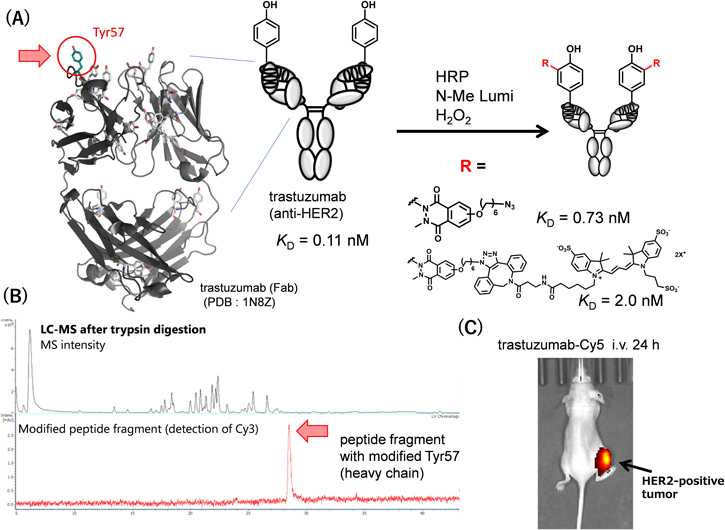
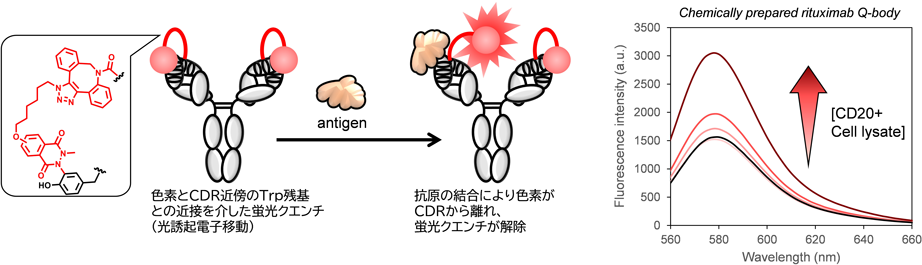
チロシン残基修飾法の開発と抗体の部位選択的修飾Development of tyrosine modification and site-selective functionalization of antibodies
東北大学学際科学フロンティア研究所Frontier Research Institute for Interdisciplinary Sciences, Tohoku University ◇ 〒980–8577 宮城県仙台市青葉区片平2–1–1 ◇ 2–1–1 Katahira, Aoba-ku, Sendai-shi, Miyagi 980–8577, Japan