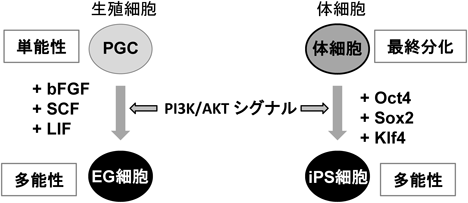
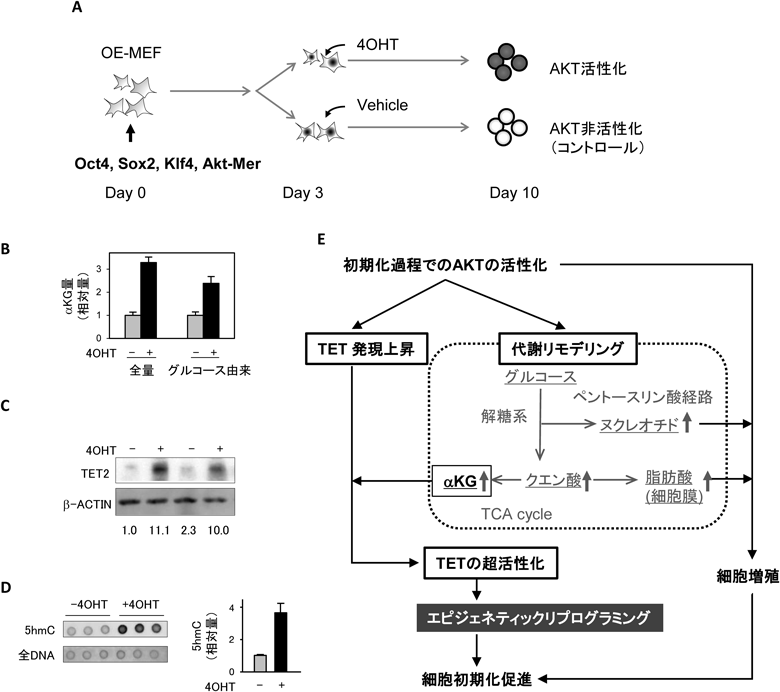
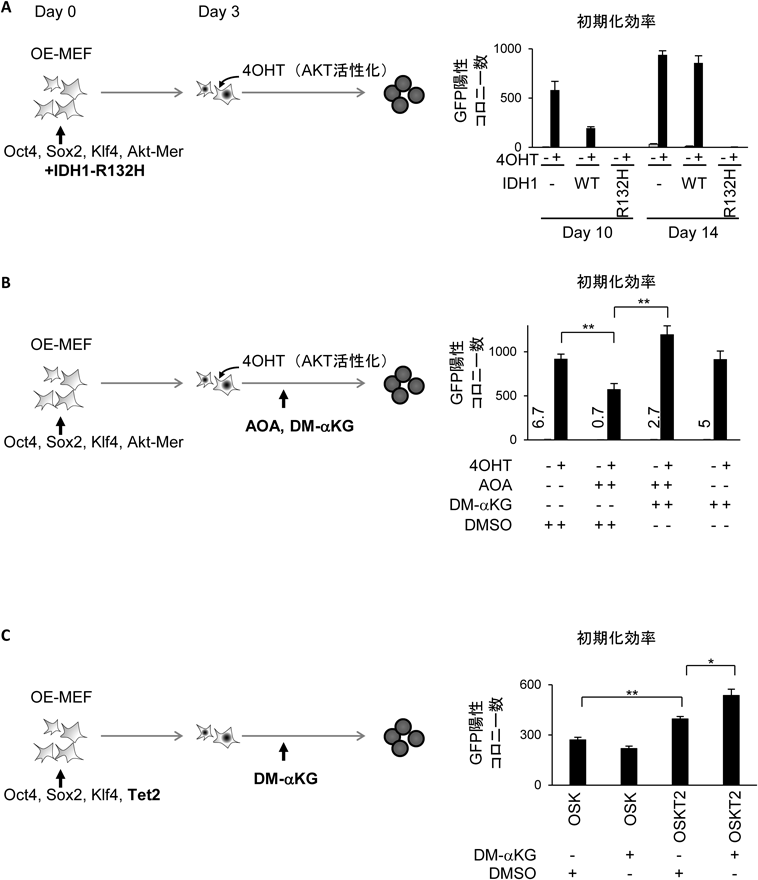
AKTシグナルによる細胞初期化促進の分子機構Mechanism of promotion of cell reprogramming by AKT signal
北里大学理学部生物科学科幹細胞学講座Laboratory of Stem Cell Biology, Department of Biosciences, Kitasato University School of Science ◇ 〒252–0373 神奈川県相模原市南区北里1–15–1 ◇ 1–15–1 Kitasato, Minami-ku, Sagamihara-shi, Kanagawa 252–0373, Japan