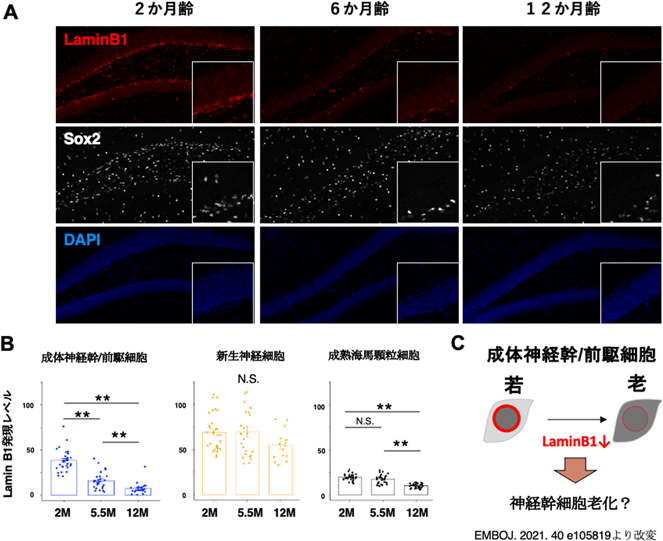
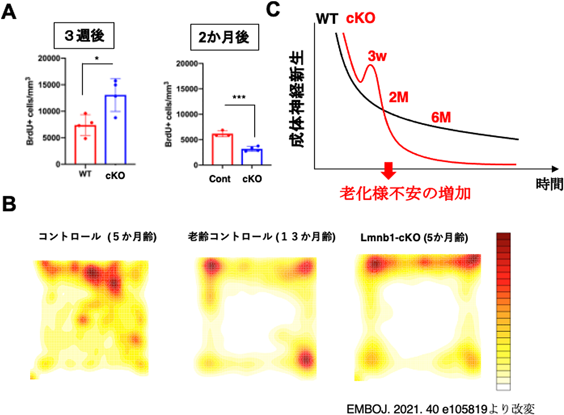
核内構造タンパク質を介した神経幹細胞維持機構とその老化Nuclear structural proteins underlying the long-term maintenance and aging of neural stem cells
1 エアランゲン大学医学部医学物理学研究所Institute of Medical Physics and Micro-tissue Engineering, Faculty of Medicine, Friedrich-Alexander-Universität Erlangen-Nürnberg ◇ Fahrstrasse 17, 91054 Erlangen, Germany ◇ Fahrstrasse 17, 91054 Erlangen, Germany
2 ドイツ神経変性疾患研究センター (DZNE)Laboratory for Nuclear Architecture in Neural Plasticity and Aging, German Center for Neurodegenerative Diseases (DZNE) ◇ Tatzberg 41, 01307 Dresden, Germany ◇ Tatzberg 41, 01307 Dresden, Germany