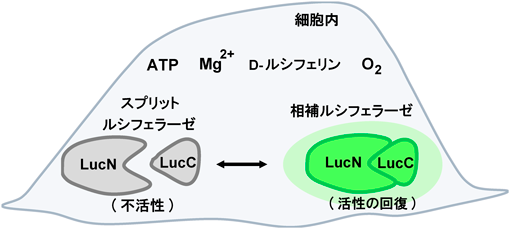
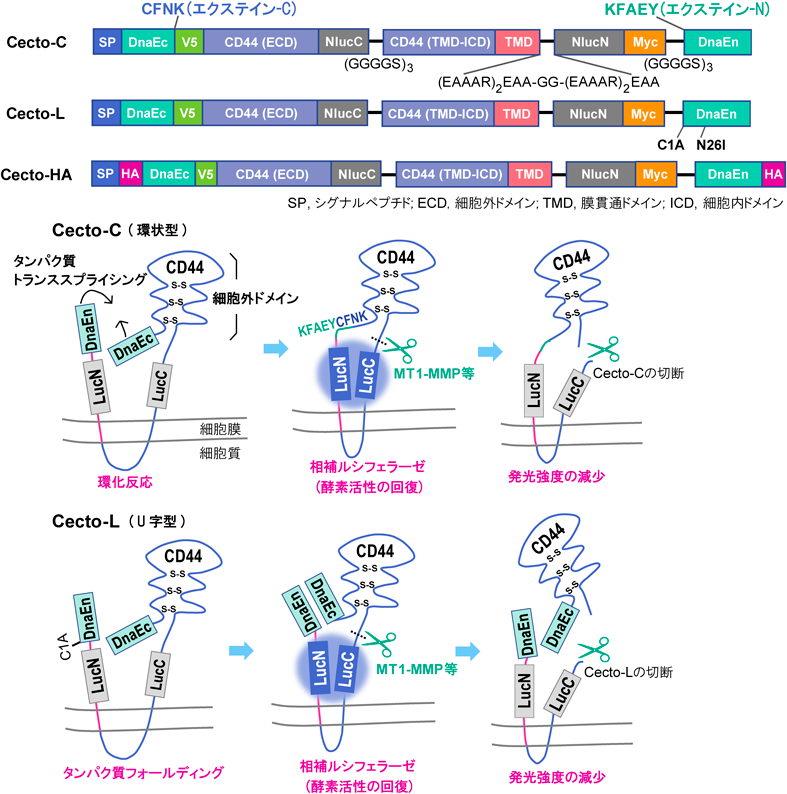
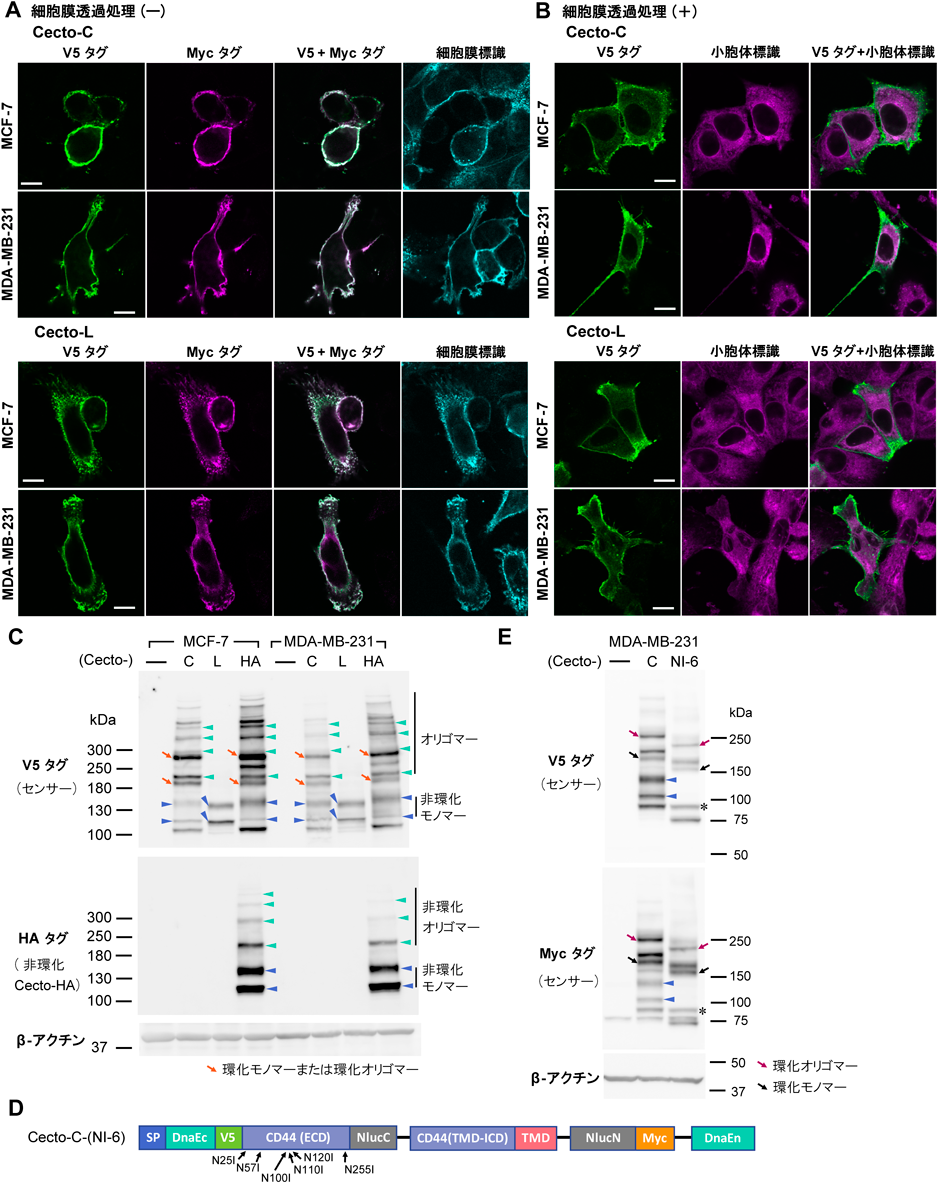
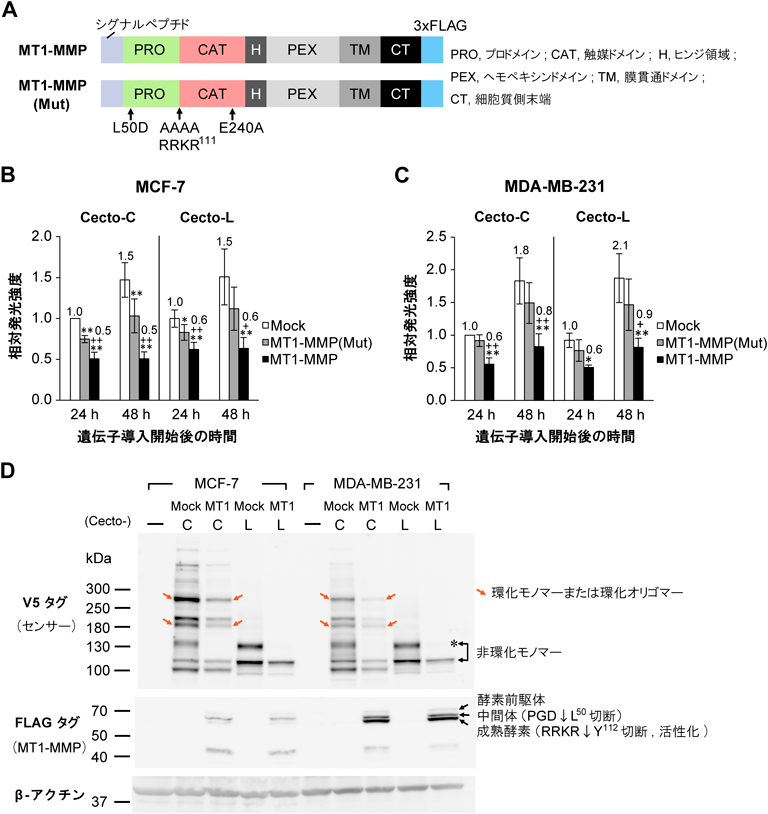
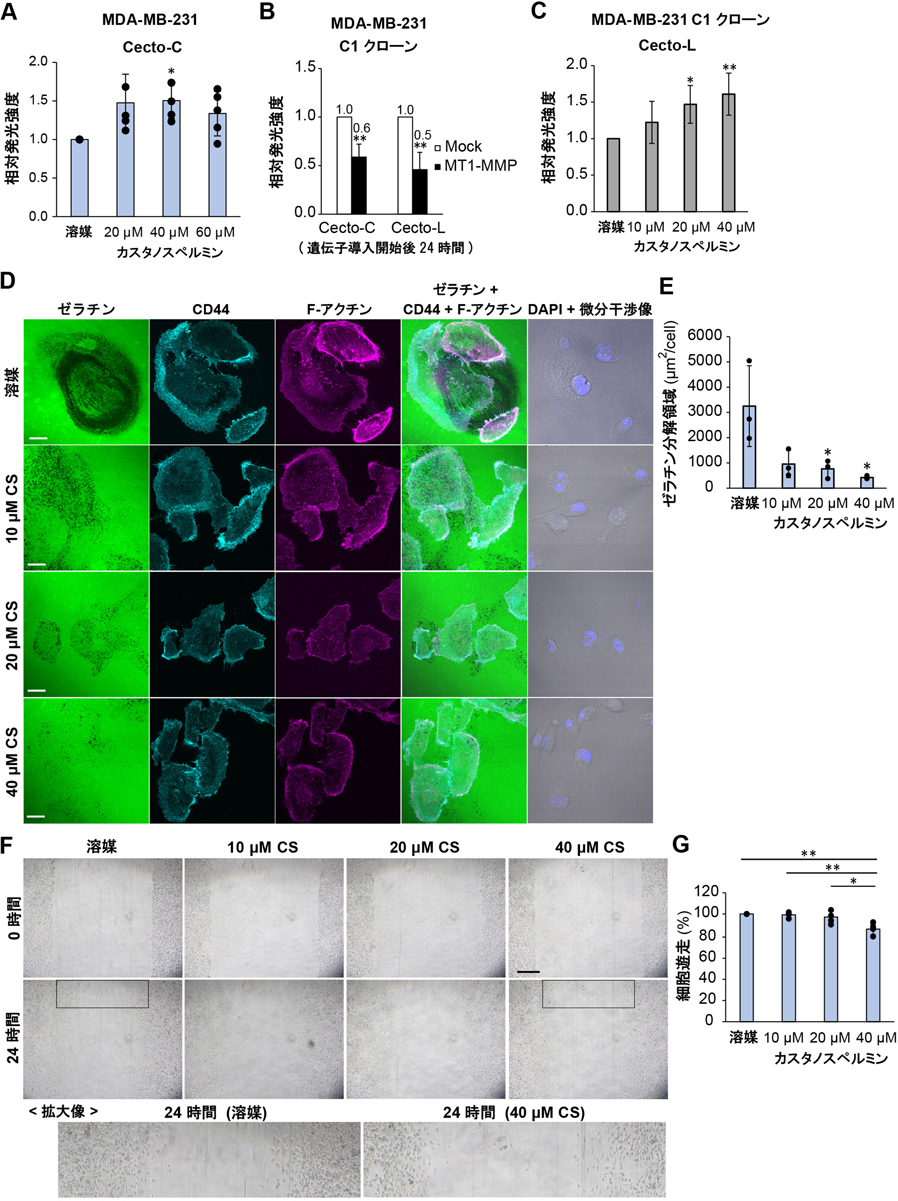
CD44細胞外ドメインの切断を検出する生物発光センサーの開発と乳がん細胞への応用Development of CD44 bioluminescent sensors to detect the ectodomain cleavage and their application to breast cancer cells
国立大学法人東京大学大学院理学系研究科化学専攻分析化学研究室Department of Chemistry, Graduate School of Science, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 ◇ 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–0033, Japan