近年新たな細胞間情報伝達機構の担い手として,細胞外小胞の一つであるエクソソームが生物学,医学の分野で注目されている.また,生体由来のナノキャリアとして,ドラッグデリバリーシステム(drug delivery system:DDS)や再生医療分野での利用においても関心が高まっている1).これまでに,mRNAやmiRNAなどの核酸の機能解析や疾患マーカー探索が精力的に行われ,また,マーカーとしてテトラスパニンなどの膜タンパク質の抗体によるエクソソームの分類,解析手法の確立が図られてきた.我々は,胃がんを発症する主な原因の一つであるピロリ菌感染の病原タンパク質CagAがエクソソームに内封されて細胞外へ放出され,胃から離れた部位へと運ばれることでさまざまな全身疾患を引き起こす可能性を報告した2).また,免疫細胞系マウスCD8+ T細胞のエクソソームは,間葉系幹細胞に取り込まれやすく,がん間質の間葉系細胞傷害とがん転移阻害作用を有することを明らかにした3).
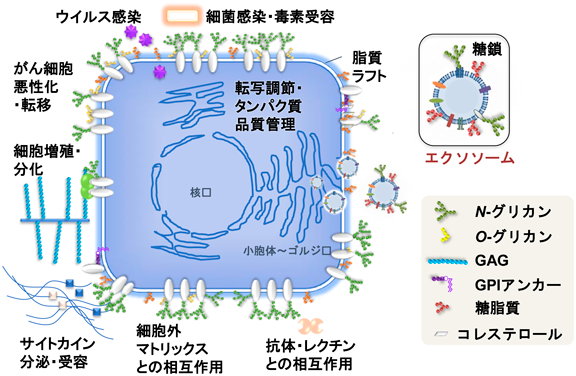
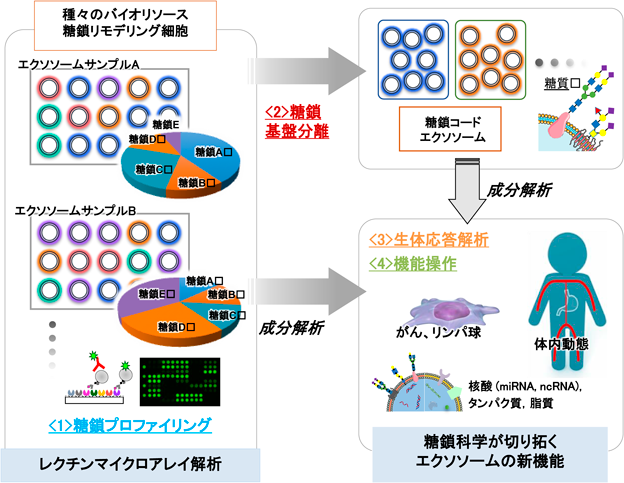
エクソソームの生体での機能解明やDDS応用展開が進む一方で,多様性のあるエクソソームの分離,構造解析技術から機能解析技術まで,さまざまな課題が残されている.細胞表層の糖鎖は,細胞の顔として,免疫,がんなどのあらゆる生体応答に関わっていることが知られており4),産生される細胞外小胞表層糖鎖も重要な役割を果たしていることが予想される(図1).しかし,細胞外小胞,エクソソームの構成成分としてのタンパク質,核酸,脂質と比べて,糖鎖構造とその機能は解析の難しさもあり,解明が遅れているのが現状である.我々は,エクソソームの多様性を表す指標としての表層糖鎖に着目した糖鎖プロファイリング技術の確立と糖鎖基盤分離システムの開発を行っている.さらに,表層糖鎖の情報をコードしたエクソソームの新規サブクラス分類手法を提案し,エクソソーム糖鎖を介したシグナル伝達・生理機能の分子メカニズム解析とその制御のための基盤技術開発研究を推進している.そのために(1)エクソソーム膜の糖鎖プロファイリング手法の確立,(2)エクソソーム膜糖鎖の多様性に基づく分離,分類手法の確立,(3)エクソソーム膜糖鎖を介した生体応答機能の解析,(4)エクソソーム機能操作のための基盤技術開発などの項目について検討している(図2).本稿では,エクソソームのレクチンマイクロアレイによるプロファイリング法とその利用,そして,エクソソーム表層糖鎖のリモデリングと細胞間相互作用,エクソソームDDSのための機能化について,我々の研究について解説する.
エクソソームは由来細胞,形成過程,サイズ,内包物などが異なる微粒子の総称である.これらを分離,精製する方法としてタンパク質や核酸のプロファイリングが多く行われているが,細胞から放出されるさまざまなエクソソームの多様性を表すことができる評価手法の開発は十分とはいえない.今後エクソソームの医療応用に向けての標準化の基準の一つとして,エクソソーム集団の多様性を示すパラメーター(指標)は重要と考えられる.
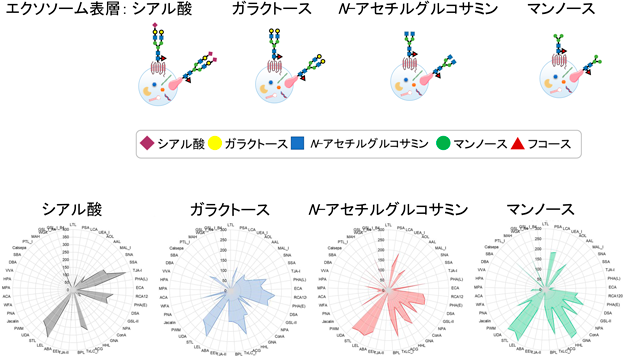
我々は,エクソソーム表層のタンパク質や脂質を覆う糖鎖がエクソソームの多様性を評価する指標となりえることを提案している.特に,エバネッセント波蛍光励起レクチンマイクロアレイ法によるエクソソーム集団の表層糖鎖パターン解析手法が有用であることを明らかにした.がん細胞や正常細胞を含む20種類の培養細胞からエクソソームを回収し,その表層糖鎖を45種類のレクチンがスライドグラス上に固定化されたレクチンマイクロアレイで解析した.その結果,細胞の種類によって糖鎖パターンは大きく異なり,由来細胞の糖鎖を反映した糖鎖プロファイリングが観察された7).
次に,エクソソームのサイズの違いによる糖鎖パターンの変化を評価するために,低速遠心分離(2000×g>, 10,000×g)および超遠心分離(120,000×g)で得られる3種類のサイズ(Large, Middle, Small)のエクソソームを回収し,レクチンマイクロアレイ解析を行った.前立腺がん細胞由来のエクソソームにおいて,分離サイズにより糖鎖パターンは異なり,Large>Middle>Smallの順に強く結合するレクチン1種類(Amaranthus caudatus agglutinin:ACA)と,逆のSmall>Middle>Largeの順に強く結合するレクチン4種類[Ricinus communis agglutinin I(RCA120),Phaseolus vulgaris erythroagglutinin(PHA-E, Datura stramonium agglutinin(DSA),Tulipa gesneriana agglutinin(TxLC_I)]を同定した.さらに,超遠心分離法の他にエクソソームの表層の脂質とのアフィニティー法(2種類),サイズクロマトグラフィー法の計4種類の方法にてエクソソームを回収し,糖鎖パターンを比較したところ回収方法の違いにより明らかに異なることがわかった.これらの結果から,エクソソームの多様性の指標の一つとして,レクチンマイクロアレイによる糖鎖パターン解析が有用であることが示唆された7).
1)iPS細胞由来エクソソームの糖鎖プロファイリング
ヒトiPS細胞と非ヒトiPS細胞(間葉系幹細胞,線維芽細胞)の培養上清から,エクソソーム表層のホスファチジルセリン(PS)に特異的に結合するTim4を用いてエクソソームを精製し,96種のレクチンが固定化された高密度レクチンマイクロアレイで糖鎖プロファイルを比較した.得られたデータをクラスター解析した結果,ヒトiPS細胞と非ヒトiPS細胞の大きく二つのクラスターに分離された8, 9).さらに,以前我々が発見したヒトiPS細胞特異的レクチン(rBC2LCN)10)は,ヒトiPS細胞由来エクソソームに結合するものの,非ヒトiPS細胞由来エクソソームには結合しなかった.フローサイトメトリーで解析したところ,ヒトiPS細胞特異的レクチン(rBC2LCN)は,ヒトiPS細胞由来エクソソームには結合したものの,ヒト線維芽細胞やヒト間葉系幹細胞由来エクソソームには結合しなかった.また,ヒトiPS細胞糖鎖マーカー(TRA-1-60, SSEA4, R-10G)抗体も,ヒトiPS細胞由来エクソソームに結合したものの,非iPS細胞由来エクソソームには結合しなかった.さらにTim4-BC2LCNサンドイッチアッセイを構築することで,ヒトiPS細胞由来エクソソームを特異的に検出する技術を開発した.以上の結果から,エクソソーム表層糖鎖は細胞表層糖鎖を反映していると結論づけた.
2)間葉系幹細胞の分化マーカーとしてのエクソソーム表層糖鎖
間葉系幹細胞は骨芽,脂肪,軟骨細胞などあらゆる種類の細胞への分化能を持つことから,特に再生医療分野で大きな注目を集めている.細胞の状態の変化と細胞表層の糖鎖パターンは密接な関係があることから,エクソソームの表層糖鎖が分化にどう影響するかどうかを評価した.まず脂肪由来間葉系幹細胞を培養し未分化の状態でエクソソームを回収し,その後骨芽細胞へと分化させ同様にエクソソームを得た.レクチンマイクロアレイ解析にてこれらの糖鎖パターンを比較すると分化前後で結合が強くなるレクチン4種類(Erythrina cristagalli agglutinin(ECA),Bauhinia purpurea lectin(BPL),Wisteria floribunda lectin(WFA),Soybean agglutinin(SBA)を同定した.この結果より,エクソソームの表層糖鎖は分化マーカーとしても機能することがわかった11).
3)アルツハイマー病患者血清由来エクソソームの糖鎖プロファイリング
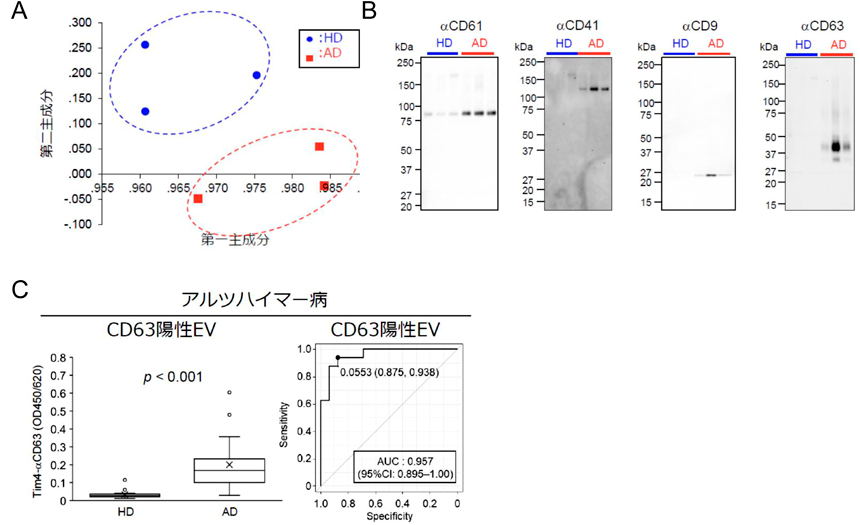
上記したようにエクソソーム表層糖鎖は細胞表層糖鎖を反映している.そのため,病態細胞から分泌されるエクソソームには正常とは異なる異常糖鎖が発現しているのではないかと考えた.そこで健常者,およびアルツハイマー病患者血清からエクソソームを分離精製し,高密度レクチンマイクロアレイで糖鎖プロファイリングを行った.健常者血清由来エクソソームとアルツハイマー病患者血清由来エクソソームで明確に異なる糖鎖プロファイルを示すことがわかった(図3A).13種のレクチンが統計的に顕著に差のあるレクチンとして抽出され,そのうちの8種のレクチンはマンノースに特異性を示した.マンノース結合性レクチンの一種であるrPALaでレクチンブロットしたところ,約80 kDaに単一の陽性バンドが確認された.80 kDaのバンドをプロテオミクスで解析すると,CD61(インテグリンβ3)であることがわかった.CD61はCD41と複合体を形成し,血小板に特異的に発現している分子である.
実際に健常者とアルツハイマー病患者血清由来エクソソームを電気泳動し,血小板マーカー(CD61, CD41)抗体およびエクソソームマーカー(CD9, CD63)抗体でブロットすると,いずれもアルツハイマー病患者血清由来エクソソームに強い反応性を示した(図3B).Tim4とエクソソーム/血小板マーカー抗体を用いたサンドイッチアッセイを構築し,健常者とアルツハイマー病患者血清中のエクソソーム(CD9陽性EV, CD63陽性EV, CD81陽性EV),および血小板由来エクソソーム(CD61陽性EV, CD41陽性EV)の量的違いを測定した.その結果,CD81陽性EV以外のエクソソームは健常者血清と比べアルツハイマー病患者血清で有意に増加していた.これらエクソソームのうち,CD63陽性EVの健常者とアルツハイマー病患者の識別能はAUC:0.957と最も高い値を示した(図3C).本結果は,アルツハイマー病の病態解明につながるとともに,アルツハイマー病診断に貢献する新たな知見であると考えている12).
4)膵がん患者血清由来エクソソームの糖鎖プロファイリング
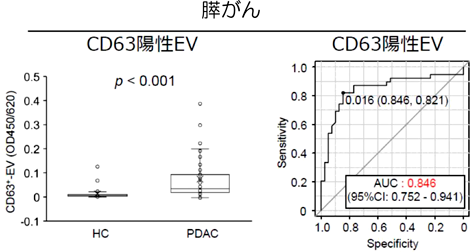
血中エクソソーム量の増加はアルツハイマー病特異的なものであろうか.我々は,さまざまな疾患,たとえばがん患者血清中でも同様に増加しているのではないかと考えた.そこで膵がんでも同様に血中エクソソームが増加するのかどうかについて検討した.その結果,エクソソーム(CD9陽性EV, CD63陽性EV),および血小板由来エクソソーム(CD61陽性EV, CD41陽性EV)はいずれも膵がん患者血清で増加していることがわかった.膵がん識別能をROC曲線で解析すると,CD41陽性EV(AUC:0.678),CD61陽性EV(AUC:0.652)と比べ,CD63陽性EV(AUC:0.846)は最も高い診断能を示し,その値はC19-9(AUC:0.842)とほぼ同等であった(図4).血清EVとCA19-9の相関性を解析した結果,血小板由来のCD41陽性EVとCD61陽性EVは予想されたとおり最も高い相関性を示した(ρ=0.742).CD41陽性EVとCD61陽性EVは,CD63陽性EVとは中程度の相関を示した(それぞれ,ρ=0.687, ρ=0.574).いずれの血清由来EV(CD63陽性EV, CD41陽性EV, CD61陽性EV)もCA19-9と低い相関を示した(それぞれ,ρ=0.376, ρ=0.213, ρ=0.243).そのため,血清由来EVはCA19-9とは異なる機構で,膵がん患者血清で増加していると考えられた.
さらに早期ステージ(I, II)の膵がんに対する診断能を解析するために,早期ステージ(I, II)と後期ステージ(III, IV)におけるEV量を解析した.CA19-9は早期ステージと比べ,後期ステージで顕著に高い値を示した.CA19-9の診断能は早期膵がん(AUC:0.814)と比べ,後期膵がん(AUC:0.883)に対して顕著に高かった.一方,いずれの血清由来EV(CD63陽性EV, CD41陽性EV, CD61陽性EV)も早期膵がんと後期膵がんで顕著な違いはみられなかった.記載したとおり,CD63陽性EVはCA19-9と相関を示さなかった.そこで,CD63陽性EVとCA19-9の組合わせモデルの早期膵がんに対する診断能を解析した.CA19-9単独の早期膵がん診断能は0.814であったのに対し,CD63陽性EV×CA19-9は0.906と高い識別能を示すことがわかった.さらにいずれの血清由来EV量も外科的切除後に顕著に低下することがわかった.そのため,血清EV量の増加は腫瘍依存的であることがわかった.以上の結果から,血清由来EVは膵がんの腫瘍依存的に増加し,またCD63陽性EVは膵がんに対して高い診断能を示すことがわかった.CA19-9と組み合わせることで,早期膵がんの診断に利用できるかもしれない.
以上から,エクソソーム(CD9陽性EV, CD63陽性EV),および血小板由来エクソソーム(CD61陽性EV, CD41陽性EV)はアルツハイマー病や膵がんなどのさまざまな疾病の早期から増加することがわかった13).これらエクソソームが血中で増加する機構は明らかにされていないが,疾患早期により引き起こされた免疫応答等により活性化された血小板等から分泌され,血中量が増加したのではないかと考えている.これらエクソソームと病態との関係に興味が持たれるとともに,健康の指標としての応用が期待できる.
5. 表層糖鎖改変技術と細胞との相互作用における役割
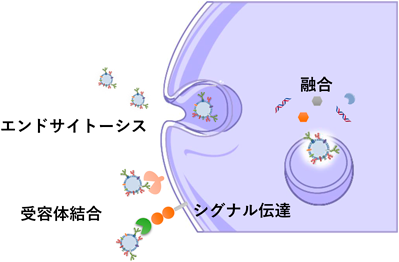
細胞表層には糖鎖を認識する受容体が多く発現しており,特に免疫反応において重要な役割を果たしている14).細胞から分泌されたエクソソームは受け手の細胞と相互作用し細胞内で情報を伝達するが,細胞への取り込みは主にエンドサイトーシス経路とされ細胞膜上のさまざまな受容体と相互作用することが報告されている15)(図5).
我々のグループはこれまでの検討でエクソソームがシアル酸認識レクチンと強く相互作用することを見いだしたことから,マクロファージや樹状細胞などの免疫細胞に多く発現しているシアル酸認識レクチンであるSiglec(sialic-acid-binding immunoglobulin-like lectin)を介した取り込み経路があるのではないかと考えた.Siglec陽性の培養細胞における取り込みの検討ではエクソソームを添加する前にシアル酸や抗Siglec抗体を前処理することで細胞内への取り込み効率が減少した.さらに,マウスへ皮下投与後にリンパ節を取り出し,その移行性を解析すると抗原提示細胞のうち,Siglec陽性細胞へ選択的に取り込まれることがわかった.これにより,エクソソームは表層の糖鎖を介した取り込み機構が存在することが明らかとなった16).
ターゲットとなる細胞へと特異的にエクソソームを作用させるには表層を改変して効率を向上させることが必要である.そこで,糖切断酵素や糖転移酵素を用いてエクソソームの表層糖鎖を改変し細胞との相互作用をコントロールできるかどうかを検討した.未処理のエクソソームは表層がシアル酸で覆われているが,これに段階的に糖切断酵素を反応させることで表層をガラクトース,N-アセチルグルコサミン,マンノースへと変えることに成功した(図6).また,切断後のエクソソームに糖転移酵素を作用させることで再度シアル酸を付与することが可能であった7).このようにして表層糖鎖がシアル酸,ガラクトース,N-アセチルグルコサミン,マンノースである4種類のエクソソームをがん細胞や線維芽細胞へと添加して取り込み量を比較すると,細胞の種類によって4種類のエクソソームの取り込み効率が異なることがわかった7).さらに,マウスへ静脈投与して24時間後の組織移行性を観察すると多くは肝臓や脾臓へと取り込まれ,脾臓においては表層糖鎖の違いにより集積量に顕著な差がみられた7).糖鎖改変技術により,がん細胞に特異的に発現する糖鎖受容体へのターゲティングが期待できる.
6. エクソソーム表層工学による機能化と細胞内デリバリー
近年,エクソソームの医療応用と関連して,機能性合成分子や高分子を化学的,物理的にエクソソーム表層に修飾,機能化する手法が報告されている17).我々は,リポソームとの融合によるエクソソームの機能化手法を開発している18, 19).ここでは,生体由来エクソソームの細胞内取り込み機能を促進する新規手法として,疎水化多糖ナノゲルによりエクソソーム表層を被覆機能化する手法について述べる.
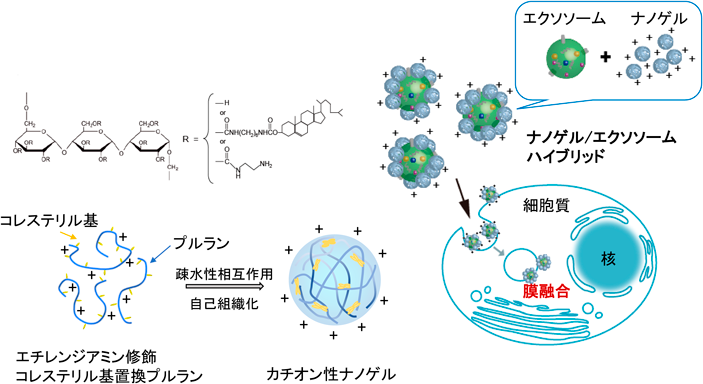
我々は,多糖にコレステロール基などの疎水基を部分的に導入した水中で自己会合したナノ微粒子,ナノゲルを形成することを見いだし,タンパク質の包接機能を利用したがんワクチンや経鼻ワクチンの抗原デリバリーシステムとして優れていることを報告している20).また,直鎖状の多糖であるプルランにコレステロール基を置換したナノゲル(CHPナノゲル)は,そのコレステロール基がリポソームの脂質ドメインとの間の疎水性相互作用によりアンカリングして,リポソーム表面を被覆した人工細胞外マトリックスとして機能しえることを明らかにしている21).この特性を利用して,エクソソーム表層を多糖ナノゲルで被覆したハイブリッドエクソソームの構築と細胞内デリバリーについて検討した.
エチレンジアミンを修飾したコレステリル基置換プルラン多糖誘導体が形成するカチオン性ナノゲル(cCHPナノゲル)は,細胞への取り込み効率がきわめて高いこと,さらに経鼻ワクチン抗原デリバリー系では粘膜に長期間付着し,さらに粘膜透過を促進することを報告している22, 23).このcCHPナノゲルは混合するだけで,エクソソーム表層を被覆し,cCHPナノゲルで覆われたハイブリッドエクソソームが調製しえることがわかった(図7).カチオン性ナノゲルが表層に複合化されることで,エクソソームの表面電位は正に増加し,細胞取り込みは劇的に増加した.多糖ハイブリッドエクソソームは細胞表層に効率よく吸着し,その後,エンドサイトーシス機構により取り込まれた.さらに,エンドソームと融合するというエクソソーム本来の機能が保持されていることも明らかになった.次に,ハイブリッドエクソソームのmiRNA細胞質内デリバリー機能について検討した.内包するmiRNAにより脂肪由来間葉系幹細胞を神経様細胞へと分化させる機能が知られているPC12細胞由来エクソソームとcCHPナノゲルハイブリッドを調製した.神経様細胞への分化は,ハイブリッド化により大きく促進された24).
また,磁気誘導によりエクソソームを細胞内に効率よく送達するシステムを開発した.以前に報告したコレステロール置換プルラン(CHP)と酸化鉄ナノ微粒子が複合化された磁性ナノゲル25)は,前述のナノゲルと同様にエクソソームと容易にハイブリッド化して,ハイブリッド磁性エクソソームを構築しえた.この磁性エクソソームは,細胞培養細胞容器の下部に磁石を設置した磁気誘導システムにより,通常のエクソソームの細胞内取り込みの10倍以上の高い効率で細胞内デリバリーが可能となった26).
エクソソーム自体でも細胞へ取り込まれることは知られているが,必ずしもその効率は高くはなく,エクソソームの細胞機能制御研究においても,多量のエクソソームを必要とするなど課題も残されている.本ハイブリッド手法は,エクソソームの機能解析研究に有用であると考えられる.複合化するCHPナノゲルはナノキャリアとしてさまざまな機能を有している27).そのため,エクソソーム本来の機能に加えてナノゲルに薬剤を搭載することで相乗効果を期待しえる従来にないハイブリッドエクソソームDDSを構築できると考えられる.さらに,我々は,pH,光,温度応答性を付与した機能性ナノゲルをすでに開発しており28),それらを複合化した刺激応答性ハイブリッドエクソソームの開発も可能となり,新規なエクソソーム表層工学としての展開が期待される.