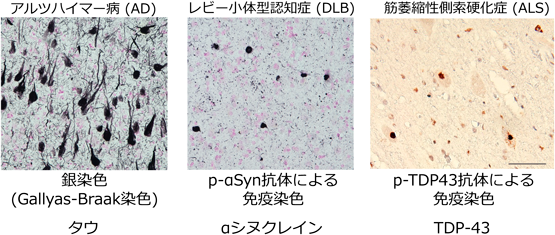
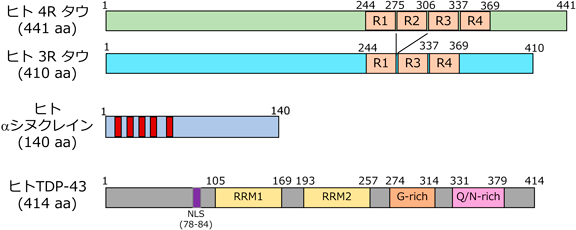
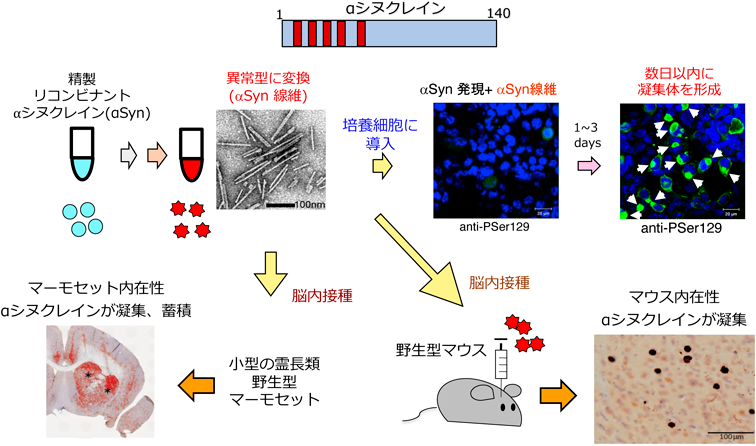
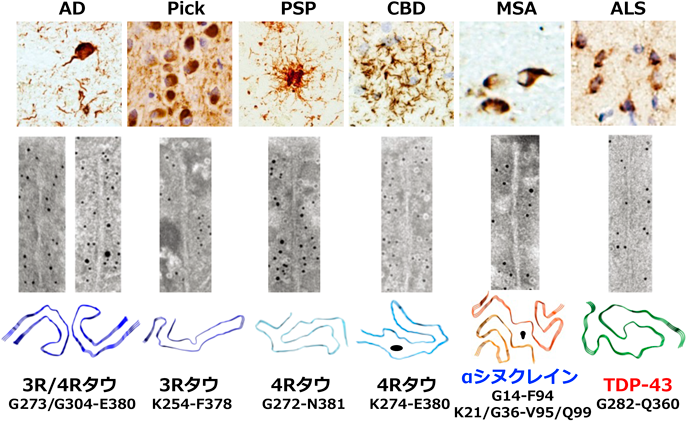
神経変性の原因となるタンパク質微粒子の形成と伝播機構Molecular mechanisms of formation of pathological protein aggregates and propagation in neurodegenerative diseases
東京都医学総合研究所脳・神経科学研究分野Tokyo Metropolitan Institute of Medical Science ◇ 〒156–8506 東京都世田谷区上北沢2–1–6 ◇ 2–1–6 Kamikitazawa, Setagaya-ku, Tokyo 156–8506, Japan