リンパ管は血管に並ぶ第二の体液輸送系として全身に張り巡らされた脈管系である.血管が静脈・動脈からなる血液が循環する閉鎖構造となっているのに対して,リンパ管は末梢組織に存在する毛細リンパ管に端を発し,その後集合リンパ管を経て鎖骨下静脈と接続し,リンパ液を鎖骨下静脈から静脈内に排出するという単方向の流れを持つ開放構造をしている.末梢組織や臓器内の組織液や細胞からの不要な代謝物の回収に加えて,リンパ系は後述するリンパ内皮の特殊な構造から,免疫細胞・抗原あるいは脂質運搬体などの比較的高分子量,大きなサイズの物質の通路としての役割を担う.末梢のリンパ管は皮下組織から始まって二次リンパ組織であるリンパ節に接続しており,リンパ管より流入した抗原や病原体を樹状細胞やマクロファージが取り込んだのちに,T細胞,B細胞などのリンパ球に対して抗原提示することで,生体の防御に必要な免疫の調節を行う.このようにリンパ節・リンパ管で構成されるリンパシステムは免疫制御の場として中心的な役割を果たしていることから,薬物送達の標的あるいは経路としてきわめて重要である.しかしながら,リンパシステムを流れるリンパ液は無色透明であることもあり,リンパ管を目視で識別することは困難である.このため,目視で単離可能な血管と比べると,その研究は遅れていた.近年の分子生物学の技術発達により,2000年ごろにリンパ管を構成するリンパ管内皮細胞(lymphatic endothelial cell:LEC)のマーカータンパク質として,lymphatic vessel endothelial hyaluronan receptor 1(LYVE-1),podoplanin(PDPN)などが同定されたことで組織からのリンパ管の識別や単離が可能になり,リンパ管やLECの生理的状態・疾患状態における機能解析が進みつつある1).
これらの背景から,我々はリンパシステム内におけるナノ粒子の動態制御による薬物送達技術,さらにはリンパを構成するLECの機能制御を目的としたナノ粒子による核酸送達技術の開発を進めてきたのでその一端を紹介したい.
リンパ管やリンパ節の内腔は独自の構成細胞であるLECにより形作られており,血管壁の構造とは異なる,その機能に即した特殊な構造を有している.末梢リンパ管では,血管でみられるコラーゲン等のタンパク質で構成される基底膜やペリサイトなどの裏打ち細胞を持たない.また,LECどうしはbutton-like構造と呼ばれる不連続性の結合により接着しており,内皮細胞の間隙が空いている.これらの構造的特徴により,リンパ管の壁構造は比較的分子量の大きいものを透過しやすいとされている.皮下投与された3.5 nm以上のナノ粒子は血管壁を越えないために血管系へと移行しない一方で,LECの間隙をすり抜けてリンパ系へと分布する2).このことから,ナノメートルサイズに粒径を制御されたナノ粒子はリンパシステムを標的とするのに適した物性を有しているといえる.
脂質により形成されるナノ粒子であるリポソームでも,その粒子サイズを小さくすることにより,皮下投与した投与部位への残存量が減り,近傍のリンパ節への移行量が増大することなどが報告されているが3),血管系を対象とした研究と比較すると研究が進んでいないのが現状である.これはリンパ内の粒子動態の非侵襲的な解析が困難であることが一因である.従来までリンパ系内にナノ粒子を導入する方法として,マウスの足裏に物質を投与する方法が採用されてきた.足裏に投与されたナノ粒子は膝窩リンパ節を通って,身体の深部に存在する腸骨リンパ節へと移行する4).そのため,微粒子のリンパシステム内動態の解析には実験動物を犠牲死させて深部からリンパ節を採取する必要があるため,経時的なナノ粒子の動態の評価には多大な労力が必要であった.
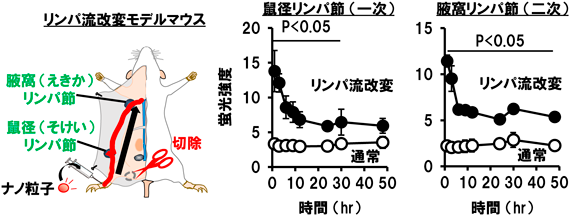
我々は,血管,リンパ管の結紮下で膝窩リンパ節を除去すると,足裏から鼠経リンパ節,腋窩リンパ節を通る体表近くのリンパ流が新たに誘導されることを偶然にも見いだした(図1,リンパ流改変モデルマウス)5).さらに,このリンパ流改変モデルマウスに投与された蛍光標識リポソームの鼠径,腋窩リンパ節への集積量はin vivo imaging system(IVIS)装置により体外から経時的に測定可能であることを明らかとしている.そこで,この外科的アプローチにより作成した「リンパ流改変モデルマウス」を用いて,物理学的特性(サイズや電荷)の異なるさまざまな粒子を投与した際の,一次リンパ節(投与部位から最も近くにあるリンパ節)およびこれを介した遠隔のリンパ節への輸送能を解析し,リンパ節間を輸送されやすい粒子(リンパ節伝播型粒子)や,逆にリンパ節にとどまりやすい粒子(リンパ節滞留型粒子)を作り分けることができるかを検証した.
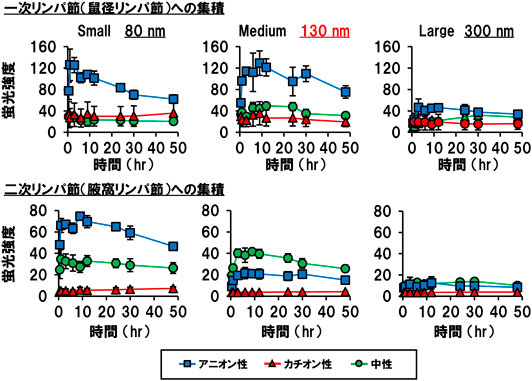
単純水和法により,リン脂質であるphosphatidylcholine(PC)とコレステロール誘導体からなる粗大なリポソームを作製し,その後整粒に使用するフィルターの孔径を変化させることで,平均粒子径が80 nm(Small),130 nm(Medium),300 nm(Large)の粒子を調製した.コレステロールの3位のヒドロキシ基が無置換のコレステロール(chol:中性)を,ヘミコハク酸がエステル結合したcholesteryl hemisuccinate(CHEMS:アニオン性),あるいはN′,N′-dimethylethylenediamineがカルバメート結合した3β-[N-(N′,N′-dimethylaminoethane)-carbamoyl]cholesterol(DC-chol:カチオン性)に置き換えることにより表面電荷をコントロールし,サイズ・表面電荷の異なる全9種のリポソームを作製した.この9種のリポソームをリンパ流改変モデルの足裏より投与し,48時間後まで経時的に,一次リンパ節として鼠経リンパ節,二次リンパ節として腋窩リンパ節のリポソーム集積量を計測した(図2).その結果,まずLargeサイズのリポソームでは表面電荷にかかわらず,リンパ節への移行はみられなかった.これは,投与した皮下間質組織において細胞外基質にトラップされ,リンパ系内へ流入できなかったことが原因であると推察される.また,Small, Mediumサイズにおいては,中性,カチオン性のリポソームと比較して,アニオン性リポソームの一次リンパ節への到達量が有意に高いことが明らかとなった.さらに特徴的な動態として,Mediumサイズのアニオン性粒子は一次リンパ節への集積量は多いものの,二次リンパ節まで移行した粒子の量は同サイズの中性粒子よりも低い値を示した.この二次リンパ節への移行量の低下は,Mediumサイズのアニオン性粒子が一次リンパ節に滞留する性質を持つことを表していると考えられる.各物性の粒子の一次リンパ節への滞留性の比較のため,「一次リンパ節のリポソーム集積量/(一次+二次リンパ節のリポソーム集積量)」の比で一次リンパ節滞留性を定義し,各タイムポイントにおける値を算出した.その結果,Smallサイズの中性,アニオン性リポソームやMediumサイズの中性リポソームでは40~70%の値を示した一方で,Mediumサイズのアニオン性リポソームでは80%程度と高い値を示した(図2).以上の結果から,リンパ系内に流入したアニオン性,中性のリポソームは総じて「リンパ節間を伝搬」する性質を示すが,サイズを130 nmに制御したアニオン性リポソームのみが「リンパ節に滞留」しやすい性質を示すことが明らかとなった.
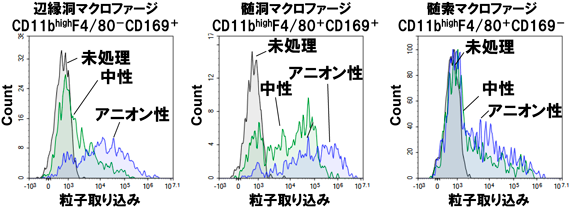
アニオン性リポソームがリンパ節に滞留しやすいメカニズムを調べるために,中性およびアニオン性リポソームのリンパ節内の局在を比較した.投与後のリンパ節を観察すると,中性リポソームと比較してアニオン性リポソームでは特に輸入リンパ管,輸出リンパ管の接続部の付近(髄洞)およびリンパ節の外側(辺縁洞)への集積が顕著であった.リンパ節の辺縁洞,髄洞にはそれぞれ固有のマクロファージが存在し,CD11bhighF4/80-CD169+(辺縁洞マクロファージ),CD11bhighF4/80+CD169+(髄洞マクロファージ),CD11bhighF4/80+CD169-(髄索マクロファージ)のサブセットとして報告されている6).これらの細胞サブセットごとに中性,アニオン性リポソームの取り込み量をフローサイトメトリーにより測定したところ,辺縁洞マクロファージおよび髄洞マクロファージでは中性と比較してアニオン性リポソームの取り込みが有意に高かった(図3).このことから,アニオン性リポソームのリンパ節の集積にはこれらのマクロファージによる粒子取り込みが関与している可能性が示唆された.特に取り込みの高かった髄洞マクロファージは,アニオン性の物質を認識するscavenger receptorの一種であるmacrophage receptor with collagenous structure(MARCO)の発現が報告されている7).また,辺縁洞マクロファージと比較してウイルス粒子などの貪食能が高いことが報告されており,100 nm近辺のサイズのアニオン性リポソームが特に取り込まれやすかったと考えられる8).一方で,細胞懸濁液を用いてex vivoでリポソームと曝露した際には,髄洞,辺縁洞マクロファージにおけるMediumサイズとSmallサイズのアニオン性リポソームの取り込みに差はみられなかった.このことは,サイズの差異によるマクロファージからの認識,貪食のされやすさの違いではMediumサイズの優れたリンパ節滞留性は説明ができないことを示唆している.おそらくリポソームのサイズの違いによるリンパ節内の分布や動態の違いが滞留性に影響したと考えられるが,現在のところMediumサイズのアニオン性リポソームが高いリンパ節滞留性を示した詳細なメカニズムについては不明である.
優れた一次リンパ節滞留性を示すリポソーム物性が同定できたことから,がんのリンパ節転移のイメージング剤としての応用について検討した.リンパ行転移の頻度が高いメラノーマや乳がんなどのがん種では,MRIやCT診断を通した経験的な判断により手術前に近傍のリンパ節を外科的にすべて取り除く(リンパ節廓清)かが判断されてきた.しかしながら,リンパ節の除去は体液の貯留によるリンパ浮腫などにより,患者のquality of lifeを著しく害する9).この方法ではリンパ節の転移の有無を確実には判断できず,リンパ節転移がないにもかかわらずリンパ節廓清が行われるケースもある.不必要なリンパ節廓清の可能性を低減するために,センチネルリンパ節(sentinel lymph node:SLN)の術中生検が試みられている.SLNはがん組織から初めにリンパ流が流入するリンパ節のことを指す.つまり,リンパ節転移を起こしているがん細胞が最初に到達するリンパ節でもある.このことから,SLNへのがんの転移がない場合には,その先のリンパ節へもがん細胞は転移していないと推定することができ,リンパ節郭清を行う必要がないと判断することができる.実際に,SLN生検による偽陰性率(SLNに転移がなかったにもかかわらずその先のリンパ節に転移していたケース)は10%程度と,高精度でリンパ節転移を予想可能であることが報告されている10).しかしながら,前述したようにリンパ管は無色透明の組織であることから,外科手術の最中に腫瘍組織からリンパ管を介してつながるリンパ節を目視で識別するのは困難である.そこで,SLNを造影するためにラジオアイソトープや蛍光色素であるインドシアニングリーンの腫瘍内投与によりSLNを単離し,その後単離したSLNの生検が行われる11).しかしながら,これらの従来の方法では,低分子化合物を使用しているためにSLNにとどまらず,すぐに二次,三次リンパ節まで拡散してしまいSLNを判別できなくなるため,SLNの同定が困難になるケースが指摘されている12).
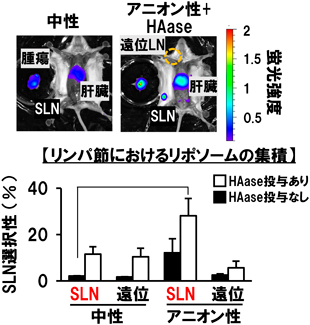
我々は,優れた一次リンパ節滞留性を示すアニオン性リポソームにイメージング剤を搭載することで,低分子化合物を用いたイメージングの弱点であるすばやいリンパシステム内そして全身への拡散を回避し,長時間観察可能なSLNイメージングが可能なのではないかと考えた.現在SLNイメージングによる術中生検が行われている乳がんへの応用を念頭に入れ,マウス乳がん細胞4T1細胞を乳房に同所移植することにより作製したモデルマウスを用いた.本モデルマウスに蛍光標識したアニオン性リポソームを投与した後に,マウスをIVISにより撮影した.また,皮下組織でLargeサイズのリポソームがまったくリンパ節へ移行しなかった結果から,投与された間質組織からリンパシステムへの流入量がSLNの検出感度を左右する要因になると推察された.しかしながら,乳がん組織はリポソームの間質組織からリンパシステムへの移行を阻害する要因の一つと考えられる細胞外基質が豊富であることが知られており13),リポソームのリンパシステムへの移行量がSLNの検出に十分でない可能性を考えた.そこで,腫瘍組織内の主要な細胞外基質の一つであるヒアルロン酸を分解する酵素(HAase)の同時投与により,SLNの撮像感度が向上するかについても検討を行った.その結果,Mediumサイズのアニオン性リポソームとHAaseを組み合わせた場合に,中性リポソームを用いた場合と比較してSLNを高感度に検出できた(図4).また,既存の低分子化合物のイメージング剤,インドシアニングリーンを用いた場合には,投与1時間後には全身に拡散してしまいSLNを判別するのが困難であった.以上のことから,リンパ節に滞留する物性を持つアニオン性のMediumサイズのリポソームは,SLNの術中のイメージングに有用であることが示唆された14).
次に粒子がリンパ節に滞留するメカニズムに立脚したSLNをイメージングする粒子の設計を行った.これまでの結果から,リンパ節内のマクロファージによる捕捉がリポソームのリンパ節滞留性を決定する要因であることが示唆された.そこで,マクロファージをより積極的に標的化するために,アニオン性脂質の一種であるphosphatidylserine(PS)に着目した.PSは細胞がアポトーシスした際に細胞膜の表側に露出しマクロファージに認識される,いわゆる“eat-me”シグナルとしての役割を持ち,マクロファージが発現する膜タンパク質Tim-4と結合する15, 16).そこで,アニオン性脂質としてコレステロール誘導体CHEMSの代わりにPSに置き換えたリポソームの処方最適化による,高感度のSLNイメージングに着手した.リポソームや投与法の最適化には,単純にPSのリポソームの組成への組み込みの有無だけではなく,添加するPSの割合,その他の脂質成分の割合など種々の要因がマクロファージによる認識に影響を与えることが考えられる.さらに,これらの作用は互いに交互作用を介してSLN滞留性に相乗的に影響すると予想される.このことから,一つ一つの要因を逐次的に検討することは,各条件間の交互作用などを見誤る可能性がある.そこで,実験計画法による最適化を行った.実験計画法では各条件(=因子)の具体的な設定条件(=水準)を直交配列表に従って割りつけ,さらに実験の順番をランダム化することにより,必要な実験数を最小限にするとともに手技や作業順番による影響を最小化する.さらに,得られた測定値を分散分析することによって,各因子の影響を推定する.これらの一連の流れを実験計画法と呼ぶ.実験計画法に関する詳細な説明はその他の文献を参照にされたい17, 18).本実験では,リン脂質(PC, PS),コレステロールの種類(chol, CHEMS),リポソームを安定化するポリエチレングリコール(PEG)結合脂質量(1, 5 mol%),整粒に用いるフィルター径(50, 100 nm),HAaseの投与(有,無)の5因子,2水準からなる条件設定を行い,腫瘍内投与後のSLNとその次のリンパ節への移行量の和でSLNへの移行量を除した比(SLN選択性)を指標とした最適化を行った.その結果,リン脂質:PS,コレステロール:chol, PEG脂質量:5 mol%,フィルター径:50 nm, HAaseの投与:あり,が最適条件として見いだされた.この最適化PSリポソームは,PSを用いないMediumサイズのCHEMS搭載アニオン性リポソームと比較して約1.5倍SLNの検出感度が高かった19).
以上のように,リンパシステム内への流入過程や,流入してからの分布過程についてリポソームをモデルのナノ粒子として網羅的な解析を行い,リンパシステム内での動態を決定する粒子側の物性を明らかにした.また,リンパ節に粒子を滞留させるためにはマクロファージによる認識・取り込みが重要な要因であることを同定した.さらに,マクロファージの生体内での分子認識機構に基づいたボトムアップ型デザインにより高感度にSLNイメージング可能な粒子を作製することに成功した.
3. 抗体を表面修飾した脂質ナノ粒子によるリンパ管内皮細胞を標的とするsiRNA送達システムの開発
LECはリンパ管という導管を構成する細胞ではなく,免疫を積極的に制御するmodulatorとしての役割が報告されており,がんワクチンや感染症への免疫応答に大きな影響を与えている.たとえば,メラノーマ組織内に存在するLECは,メラノーマ組織内に浸潤してきた細胞障害性T細胞(cytotoxic T-lymphocyte:CTL)が放出するinterferon-γ(IFN-γ)に応答して,programmed death-ligand 1(PD-L1)を発現するようになることが報告されている20).このLEC上に発現誘導されたPD-L1はCTLのprogrammed death-1(PD-1)と相互作用し,CTLの細胞障害性を低減する.また,皮下に存在する樹状細胞のリンパ節への移行には,細胞膜上のヒアルロン酸はLECが発現しているヒアルロン酸受容体であるLYVE-1との相互作用が必須であることが報告されており,LECのLYVE-1のコンディショナルノックアウトマウスでは抗原とアジュバントを皮下に投与しても,抗原を貪食した樹状細胞はリンパ節に移行できないため,結果としてCD8陽性細胞の活性化が著しく減弱する21).その他,Hennekamリンパ管拡張症–リンパ浮腫症候群や寡毛症–リンパ浮腫–毛細血管拡張症候群などのリンパ浮腫を共通の病状としながらもさまざまな病態を呈する遺伝的疾患群がLECの機能・遺伝的異常により引き起こされることが明らかにされつつある1).これらのことから,LECの遺伝子発現制御は,新たな創薬原理となりうる.しかしながら,これまでにLECの遺伝子制御を実現する技術は報告されていない.そこで,我々は最も開発の進んでいる核酸送達のモダリティとして脂質分子で構成される脂質ナノ粒子(lipid nanoparticle:LNP)により,遺伝子制御配列依存的に遺伝子発現を抑制可能なsmall interfering RNA(siRNA)をLECに送達する技術の開発を行った.
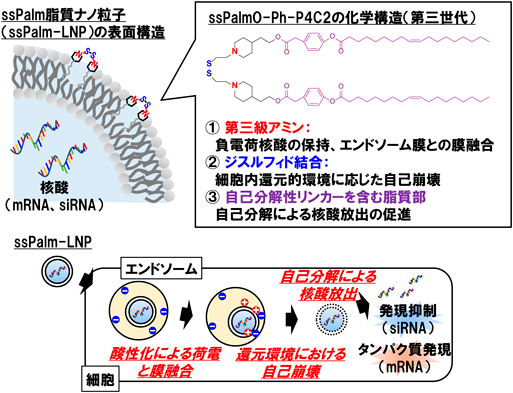
我々は,これまでにsiRNAを含む機能性核酸の細胞内動態制御による効率的送達を目的として,独自の脂質様材料SS-cleavable pH-activated lipid-like material(ssPalm)の設計を行っている22–24).最新型のssPalmでは細胞内での膜融合能と自己崩壊能をコンセプトとして分子設計されており,構造内に「三級アミン」,「ジスルフィド結合」,「フェニルエステルリンカー」を有する(図5).細胞にエンドサイトーシスにより取り込まれたssPalm-LNPは酸性化に応答して「三級アミン」が正電荷を帯びることで負電荷のエンドソーム膜と膜融合を起こす.その後,細胞質に脱出したssPalm-LNPは細胞質内のグルタチオンにより「ジスルフィド結合」が還元され,チオール基が生成する.そして,求核性の高い官能基であるチオール基が分子内で「フェニルエステルリンカー」を求核攻撃しチオエステル結合を形成すると,親水部の構造が反転するため,親水部と疎水部が分極した構造を特徴とする脂質分子の構造を失う.これにより,脂質分子がLNPを自発形成する駆動力が損なわれるためにLNPは自己崩壊し,内封した核酸を効率的に細胞質に放出する.実際に,in vivoにおいて肝細胞に対してsiRNAやメッセンジャーRNAを搭載したssPalm LNPは,すでに臨床応用されているOnpattro®に用いられているカチオン性脂質MC3により構成されたLNP製剤を凌駕する核酸送達能力を有することを報告している25–27).
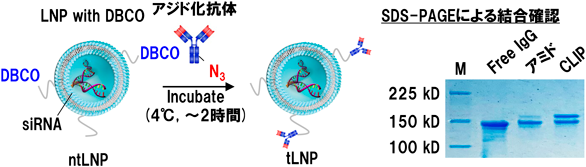
LECが存在する皮下局所にssPalm-LNPを投与した場合,LECがLNPを認識するような機構は現在のところ報告されていないことから,皮下に存在する貪食能の高い細胞に優先的に取り込まれ,LECへ取り込まれる量は僅少であることが想定される.したがって,皮下投与後にLECにsiRNAを搭載したLNPを送達するには,LNPをLECを認識する機能素子で修飾する必要がある.しかしながら,LECは前述のように比較的同定されてから歴史の浅い細胞であり,LECを特異的に認識するリガンド分子の報告は少ない.そこで,ssPalm-LNPの表面に提示させたLECのマーカータンパク質を認識する抗体分子により,LECにLNPを取り込ませる戦略を講じた.従来ナノサイズの粒子に抗体を結合させる手法として報告されている,抗体のアミノ基とナノ粒子に提示させた活性カルボン酸の間のアミドカップリング反応は反応速度が遅いために長時間の反応が必要であり,熱力学的に安定ではないLNPの不活性化の恐れがあった.また,アミドカップリングでは反応の進行率を上げるために大過剰の抗体と反応させる必要があり,その後必要な長時間の単離操作もまたLNPの不活性化に与える影響が懸念された.そこで,LNP界面上でのクリック反応を利用した,抗体結合法(click reaction on interface of nanoparticle:CLIP法)の開発に着手した28).
クリック反応としてアジド基とジベンゾシクロオクチン(DBCO)が結合する,ゆがみエネルギー促進型アジド・アルキン付加環化反応を用いた.本法は基質特異性が非常に高いためLNPのその他の構成成分などと反応する可能性が低く,また,水中でも反応速度が非常に迅速であるという特徴を有する29).これらの利点に加え,ゆがみエネルギー促進型アジド・アルキン付加環化反応では,従来のアルキンとアジドを結合させるクリック反応で必要な,生体にとって毒性を呈する可能性のある銅触媒を必要としないため,粒子作製後の個体への投与を考えると安全性の点で優れている.アンカーとしてジステアロイルグリセロホスホエタノールアミン,リンカーとして分子量2000のPEGが結合したPEG脂質の先端にDBCOが結合した脂質を搭載したLNPをアルコール希釈法により作製し,あらかじめアミドカップリングによりアジド基を付与した抗体とインキュベートとすることで結合させるスキームとした(図6).アジド基を有する蛍光分子を用いた事前の反応条件の検討の結果,pHが4程度の酸性緩衝液中においてLNPのDBCOと1当量のみ添加した抗体のアジド基間で迅速に反応が進行することが明らかとなった.その速度はおおよそ5当量のアミノ基を有する蛍光色素と活性カルボン酸を持つLNPを用いた従来のアミドカップリング法と比較して,反応のプラトーに達するまでの時間がおよそ6倍短かった.通常DBCOとアジド基による付加環化反応にはpH依存性はみられないことから,酸性液中での反応の早さはpH変化によるLNP表面のDBCO基の配向性等の変化に起因するものと考えられる.一般に酸性条件下ではpH応答性脂質を持つLNPは正に帯電するために,内封核酸の負電荷と強く相互作用し,より安定に保持することが可能であるため,核酸内封LNPに適した反応条件であると考えられる.
次に見いだした反応条件において,抗体をLNPに迅速に結合させられるかを検討した.LECの標的化には,LECマーカータンパク質PDPNを特異的に認識する抗体を用いた.アジド化した抗体とDBCOを提示させたLNPをCLIP法に最適な反応条件で反応させ,抗体とDBCPを含むPEG脂質の結合を,反応後の溶液を用いたSDS-PAGEにより分析した.その結果,抗体分子よりも移動度が小さいタンパク質のバンドが検出された(図6).超遠心により抗体とLNPを分離した後にLNP画分をSDS-PAGEにより分析したところ,移動度の小さい分子量の大きなタンパク質のみが認められたことから,これはPEG脂質を介してLNPに結合した抗体であると推定された.ImageJを用いたデンシトメトリーにより結合した抗体割合を計算したところ,添加した抗体の46%が結合していた.一方で,アミドカップリングにより抗体を結合させた場合には9.6%と低い結合率を示したことから,CLIP法が抗体を効率よくLNPに結合可能であることが示された.さらに,ヒト皮膚由来LECを用いて抗体の修飾量,脂質組成の最適化を行った結果,抗体を修飾していないLNP(non-targeted LNP:ntLNP)と比較して抗体修飾によるLEC標的化を行ったLNP(targeted LNP:tLNP)では取り込み量が5.7倍向上した.さらに,ほぼすべての細胞に発現する遺伝子であるpolo-like kinase 1(PLK1)に対するsiRNAによる遺伝子発現抑制効果を定量的RT-PCRにより評価したところ,50%の抑制に必要なsiRNA濃度はtLNPで15 nM程度であり,これはntLNPと比較しておよそ3分の1低い濃度であった.一方で,この取り込みの上昇やsiRNAによるノックダウン効果の上昇はコントロールの細胞として用いたヒト臍帯静脈血管内皮細胞HUVECでは認められなかったことから,tLNPは表面に結合させた抗体のPDPN認識により細胞に取り込まれていることが示唆された.
次に,in vivoでのtLNPによるLEC標的化について評価した.がんワクチンを適応した際のLECの作用を評価するために,モデル抗原としてオボアルブミン(OVA)を発現するTリンパ腫であるE.G-7-OVAをマウス皮下に移植することで作製したがんモデルマウスを用いた.この担がんマウスに対してOVAに対する免疫を誘導し,CTLが産生するIFN-γによるPD-L1発現を誘導したのちにPD-L1に対するsiRNAを搭載したtLNPを投与した.その後,腫瘍皮下組織から細胞懸濁液を調製しフローサイトメトリー解析を行い,LEC画分(CD45¯CD31+PDPN+)におけるPD-L1の発現を定量した.その結果,OVAに対する免疫誘導により上昇したLECのPD-L1の発現はtLNPの投与により完全にキャンセルされた.陰性対照として用いたルシフェラーゼに対するsiRNAでは,PD-L1の発現抑制は認められなかったことから,ntLNPによるLECのPD-L1発現の抑制は,送達されたsiRNAによるものであることが示された.以上より,生体内でLECの遺伝子を選択的に抑制可能な核酸送達システムの開発に成功した.今後はLECを対象とした難治性疾患への治療などへ展開していきたい.
また,今回開発したCLIP法はさまざまな抗原に対する抗体をLNPに結合させることが可能であり,さまざまな細胞種への標的性を付与する方法として汎用性の高い反応である.今後,CLIP法を用いた細胞選択的な核酸送達技術をリンパシステム内の細胞を包括的に遺伝子制御可能な戦略として応用することが期待される.