本特集では「細胞外微粒子に起因する生命現象の解明とその制御」に焦点が当てられている.“細胞外微粒子に起因する生命現象”の中で,最も深刻な,かつ,顕在している脅威は,外因性細胞外微粒子(環境中微粒子)による呼吸器,アレルギー系に係る健康影響である.世界中の多数の疫学研究が報告している「2.5 µm以下の微小粒子(PM2.5)による気管支喘息の増加,悪化」はその代表といえる.我々は,種々の環境中微粒子による気管支喘息をはじめとする呼吸器・アレルギー疾患の悪化について研究を進めてきた.
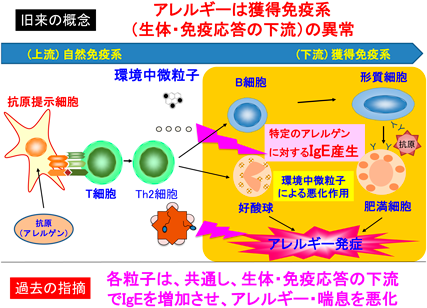
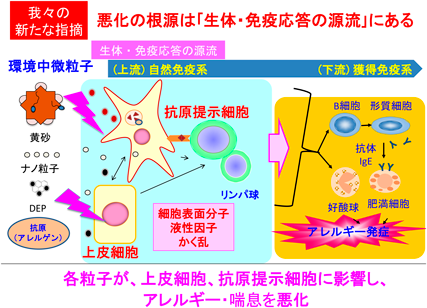
環境中微粒子は多様で,発生源,成分等の環境分析学的(外因的)特性によりもっぱら類型化されてきた.我々は,PM2.5にも含まれる金属や炭素から構成されるナノ粒子(工業由来:粒子単体),デイーゼル排気微粒子[DEP(diesel exhaust particles),化石燃料燃焼由来:粒子+芳香族炭化水素をはじめとする化学成分],黄砂(自然由来:粒子+細菌や真菌に由来する生物成分)が呼吸器・アレルギー疾患を悪化させることを実験的に示し,その機序を解明してきた.これらの粒子は,生体・免疫応答の下流で,アレルギー性(好酸球性)炎症やIgEを代表とする抗体産生等の獲得免疫系の異常を修飾し,疾患を悪化させることがわかっていた(図1).その後,我々は,環境中微粒子が抗原提示細胞や上皮細胞に作用し,その結果として,獲得免疫系を撹乱することを示し,環境中微粒子による呼吸器・アレルギー疾患悪化の本態は生体・免疫応答の上流に存在することも明らかにしてきた(図2).
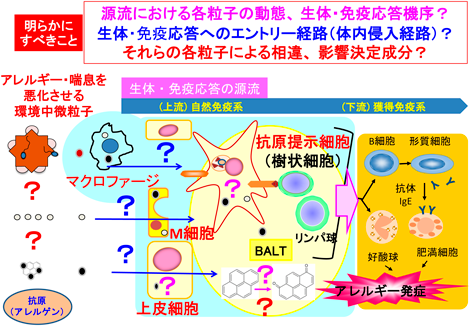
しかし,獲得免疫系の上流にある,自然免疫系を含む生体・免疫応答の源流における環境中微粒子の動態や変化,それらと生体内・細胞内イベントの関係,および,疾患悪化との因果関係に関する検討はなく,粒子による健康影響発現機序の根源的解明には至っていない.さらに,気道内に存在する環境中微粒子が,抗原提示細胞等,生体・免疫応答源流の細胞に至る経路“生体・免疫応答へのエントリー経路”も特定されていない.加えて,これらの粒子種による異同,多様な成分から構成されるPM2.5の健康影響を規定する成分や要因も明らかにされていない(図3).
我々は,「呼吸器・アレルギー疾患を悪化させる環境中微粒子の中でも,(1)生体・免疫応答へのエントリー経路,体内・細胞内動態,(2)健康影響発現(生体・免疫応答)機序は異なる.そして,(3)これらの相違を基に,環境中微粒子を医学・生物学的(内因的)特性により類型化することができる.さらに,(4)本類型化を基に,多様な環境中PM2.5の健康影響発現機序を解明し,その環境分析学的(外因的)特性と医学・生物学的(内因的)特性の相関,因果関係を,分子とその変化により連結することができる」と考え,研究を進めることとした.
本研究計画の推進にあたっては,特に,環境医学研究(両因性コミュニテイー)が核となり,環境分析学研究(外因性コミュニテイー)と医学研究(内因性コミュニテイー)の融合を目指した.これにより,応答解析研究(医学研究:内因性コミュニテイー)に欠けていた物理,化学的分析技術を導入し,高度化する一方,環境分析技術(外因性コミュニテイー)に欠けていた可視化技術を導入し,高度化することで,従来のボトルネックを解消することを目指した.
1)環境中微粒子と新型コロナウイルス感染症の関連について
2019年に報告されて以来,世界中で人々の健康を脅かし,生活様式にも変化をもたらした新型コロナウイルス感染症(COVID-19)は,severe acute respiratory syndrome coronavirus 2(SARS-CoV-2)によって引き起こされる感染症である.SARS-CoV-2はSpike proteinと呼ばれる突起構造を有し,これがヒトを含む宿主の細胞表面に存在するangiotensin-converting enzyme 2(ACE2)と結合するとともに,タンパク質分解酵素のtransmembrane protease serine type 2(TMPRSS2)によって開裂を受けることを経て,細胞内に侵入する1).
ACE2とTMPRSS2の発現の程度はCOVID-19の感染率や重症化率・死亡率と疫学的に相関し2),COVID-19の重症化率が高い喫煙者の肺ではACE2とTMPRSS2の発現が増加していることが報告されている3).動物実験においても,煙の曝露が気道のACE2の発現を増加させることが知られており4),環境要因によってACE2とTMPRSS2の発現は変動しうると考えられる.
環境要因の一つである大気中の微小粒子の吸入は,主に呼吸器への影響をもたらし,短期的な曝露であっても呼吸器感染症や慢性閉塞性肺疾患の急性増悪の頻度などを増加させることが報告されている5).COVID-19との関連については,2.5 µm以下のPM2.5や10 µm以下のPM10の濃度と,その2日後のCOVID-19による死亡率との間に正の相関がみられることなどが疫学的には知られている6).ACE2とTMPRSS2の発現への影響についてみると,PM2.5の急性曝露がマウスの肺におけるACE2の発現を増加させることがこれまでに報告されていたが7),その細胞種やTMPRSS2の発現に及ぼす影響については明らかではなかった.このような背景から,我々はPMの急性曝露後のマウスの肺におけるACE2とTMPRSS2の発現の変化をその細胞種とともに検討することとした8).
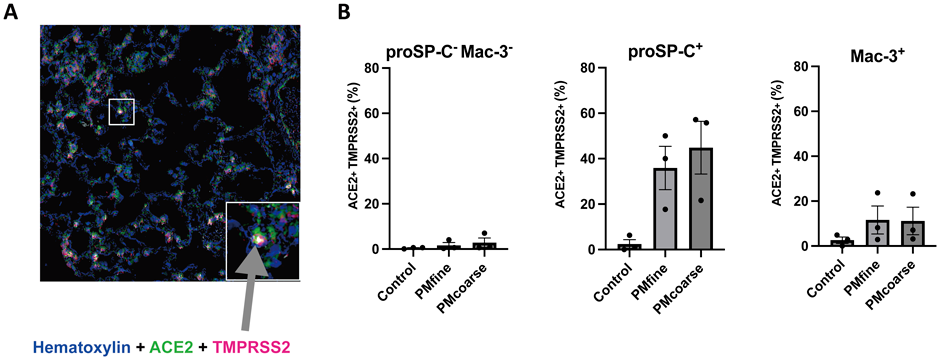
PM急性曝露モデルの作製にあたっては,サイクロンを適用した粒子採取方法によって得られた本邦の大気中のPMサンプル9)を対象とし,リン酸緩衝液(PBS)に分散させてマウスに経気道的に曝露(500 µg/body)して,24時間後に肺組織を回収した.得られた同一の肺組織切片上においてACE2とTMPRSS2およびphenotype markerの発現を解析するために,多重免疫染色およびimage cytometryという手法を用いた10).
はじめにACE2の発現状況を調べたところ,コントロール(PBS曝露後)の肺組織においては,気管支上皮細胞・血管内皮細胞に加えてマクロファージやII型肺胞上皮細胞(AT2)と思われる細胞に発現していた.TMPRSS2についてもACE2と類似した結果ではあるものの,血管内皮細胞における発現が乏しいという点が異なっていた.PM曝露後の肺組織切片においては,粒径の異なるPMfine, PMcoarseのいずれを用いた場合であっても,ACE2とTMPRSS2を発現する細胞が主に肺胞領域で増加しており,多重免疫染色を行ったところ,主に同一の細胞において二つのタンパク質が発現していることがわかった(図5A).
次いで,マクロファージとAT2のphenotype markerとして,それぞれMac-3とproSP-Cの発現状況を上述と同一の組織切片において確認すると,Mac-3陽性マクロファージ,およびproSP-C陽性AT2においてACE2とTMPRSS2が発現していることがわかった.さらに,各細胞種ごとのACE2とTMPRSS2の発現の状況を定量化するために,各個体の複数箇所における発現状況をimage cytometryによって解析した.すると,PMfineとPMcoarseの曝露を受けると,Mac-3陽性マクロファージとproSP-C陽性AT2においてACE2とTMPRSS2をともに発現する細胞の割合が著明に増加しており,特にAT2においてはその影響が顕著であることがわかった(図5B).各個体由来の結果を統合して細胞種別に解析を行った場合にも同様に,PMfineおよびPMcoarseの曝露によってMac-3陽性肺マクロファージとproSP-C陽性AT2において,ACE2とTMPRSS2をともに発現する細胞の割合が有意に増加しており,やはりAT2においてその影響が顕著であることが確認できた.
以上から,本研究によりPMの急性曝露によってマウスの肺内(特にAT2)においてACE2とTMPRSS2の発現が増加していることが示された.PMは多様なイオン,金属,炭素,多環芳香族炭化水素(polycyclic aromatic hydrocarbon:PAH),およびエンドトキシンやβグルカンなどの生物由来物質を含んでおり,今回の現象がどの成分によって引き起こされたのかはまだ明らかとはなっていない.ただし,通常急性肺障害をもたらすことが知られるエンドトキシンについては,気管内投与によって肺のACE2の発現低下をもたらすことが報告されており,エンドトキシンを除く成分が原因であろうと推察される.ヒトの肺組織においても,AT2とマクロファージがACE2とTMPRSS2を発現することが知られており,これらの細胞がSARS-CoV-2に感染することも知られている11, 12).AT2はサーファクタントの分泌をはじめ,多様な生理的機能を有することが知られており,上述のように実際に感染の標的となることを鑑みると,本研究結果はPMがCOVID-19の病態に及ぼす影響を考える上で興味深いものであったと考えられる.本研究以降も引き続き,PMを構成するどのような成分がACE2とTMPRSS2の発現を増加させるのか,その機序とともに解明すべく研究を進めている.
2)環境中微粒子の体内,細胞内動態と生体応答機序の関連について
ナノ粒子の一つである酸化チタンはヒトにおいて吸入曝露を介した健康リスクを生じることが知られている13–15).また,in vivoで急性曝露を行うと,肺胞マクロファージ(alveolar macrophages:AMs)が酸化チタン粒子を貪食することや,用量依存性に肺の炎症が惹起されることも報告されている16–18).しかし,酸化チタン粒子を貪食したAMsにどのような応答が起こることによって炎症がもたらされるのか,詳細な経路はこれまで明らかとなっておらず,我々はこの解明を目指して実験を執り行った19).
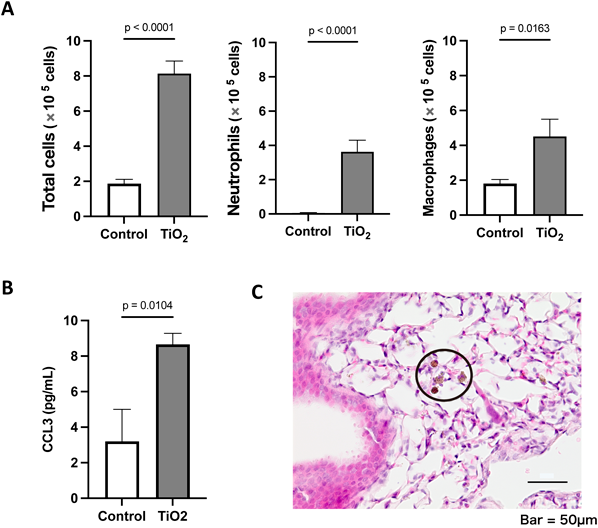
まずルチル型の酸化チタン(200 µg/body)をPBSに分散させてマウスに経気道的に曝露し,24時間後に生体に起こる変化を観察したところ,気管支肺胞洗浄液(bronchoalveolar lavage fluid:BALF)中において,好中球・マクロファージを含めた細胞数が増加すること,および白血球の遊走をもたらすケモカインの一つであるCCL3が増加することがわかった(図6A, B).
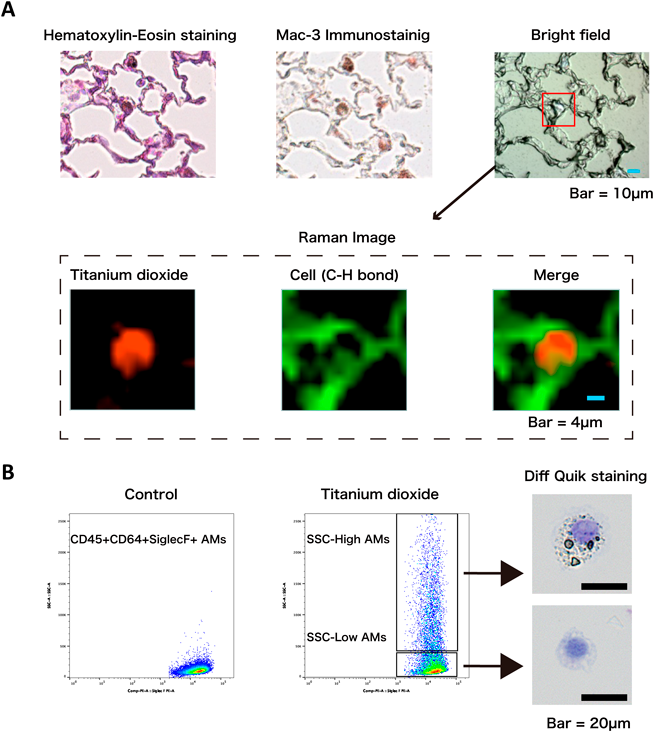
さらに,回収した肺組織にHE(hematoxylin-eosin)染色を行って観察したところ,肺胞腔における炎症細胞浸潤に加えて,一部の肺胞腔の細胞が褐色に染色されることがわかった(図6C,円内).これらの細胞種の同定および内部成分の分析のために,多重組織染色およびラマン分光分析を行った.具体的には,HE染色を施した後の肺組織を脱色し,Mac-3の免疫染色を行った後に,最終的に脱色および抗体剥離を経て,目的の細胞のラマンイメージを取得した.その結果,HE染色で褐色に染まる細胞がマクロファージであり,内部には酸化チタンが取り込まれていることを確認できた(図7A).BALFから作製したサイトスピン標本においても,Diff-Quik染色後に同様に脱色を経てラマンイメージを取得することで,やはりマクロファージが酸化チタンを貪食していることが確認できた.
次いで,このマクロファージの詳細なphenotypingのために,フローサイトメトリーによる分析を行った.BALF中の細胞からCD45+CD64+SiglecF+のAMsをgatingしたところ,酸化チタン曝露後のAMsにおいてはコントロール(PBS)の曝露時には認められない,側方散乱光(side scatter:SSC)の高い細胞集団(SSC-High AMs)が出現することがわかった(図7B).SSC-High AMsをSSCの低いAMs(SSC-Low AMs)とともにソーティングし,サイトスピン標本を作製してDiff-Quik染色を行ったところ,SSC-High AMsは異物を貪食しており,前述と同様の手法でラマンイメージを確認すると,これらの異物が酸化チタンであることがわかった.すなわち,CD45+CD64+SiglecF+のAMsが酸化チタンを貪食し,フローサイトメトリーではSSCの高い細胞集団として同定できることが示された.
SSC-High AMsとSSC-Low AMsとは明らかに形態的な差異があり,これまでに酸化チタンを貪食した細胞がアポトーシス(apoptosis)を起こすことも報告されていたため20, 21),フローサイトメトリーによってAnnexin V/7-AADの陽性率を評価した.その結果,SSC-High AMsは,コントロール曝露後のAMsやSSC-Low AMsと比して有意に7-AAD陽性率が高いこと,またその大半が7-AAD+Annexin V-であり,細胞膜の破綻を伴う細胞死を起こしていることが判明した.
近年,これまでnecrosisとして認識されてきた細胞膜の破綻を伴う細胞死の中にも,シグナル伝達によって調節される細胞死(regulated cell death:RCD)が存在することが報告されており,ナノ粒子の一つであるアラム粒子を貪食したAMsがnecroptosisを起こすこと22),さらにはin vitroでは酸化チタンもこの細胞死を誘導しうることが知られていた23–25).そこで,necroptosisのキーとなるタンパク質であるpMLKLの発現を肺組織とBALF中の細胞において確認したところ,Mac-3陽性細胞およびソーティングしたSSC-High AMsがpMLKLを発現していることがわかった.さらにnecroptosisの阻害剤であるNec-1sをマウスに投与すると,SSC-High AMsの7-AAD陽性率が有意に抑制され,同様に初代培養AMsに対する酸化チタンの曝露の際にもNec-1sを添加することによって,死細胞に由来するEth-D-IIIの蛍光強度が有意に低下した.
以上から,酸化チタンを貪食したAMsがnecroptosisを起こすことが確かめられ,さらにはNec-1sの投与はBALF中や初代培養AMsの培養上清中のCCL3の分泌を抑制し,BALF中の好中球の増加をも抑制していることがわかった.これらの結果を総合すると,酸化チタンを貪食したAMsがnecroptosisを起こすことによって,CCL3の分泌が増加し,急性炎症の目安となる好中球の遊走を惹起しているものと考えられた.
本研究では,酸化チタンの急性曝露によってAMsのnecroptosisがもたらされることを示したが,実際の生体内ではさまざまな細胞種において多様な細胞死が同時に起こっていると推測され,さらには経時的にこれらは変化するものと考えられる.また,細胞死が必ずしも炎症を悪化させるのかどうか,どのようなシグナルと関与するのか,といったこと点もいまだ不明であり,今後解き明かしていくべき課題の一つである.
3)環境中微粒子の細胞内動態について
我々は,呼吸器・アレルギー疾患を悪化させる環境中微粒子の健康影響発現機序を解明するため,環境中微粒子の細胞内局在の可視化も進めている26).これまでの一般的な二次元での細胞観察では,環境中微粒子が細胞内に取り込まれているのか,あるいは,細胞外に存在しているのか,明確に区別することができなかった.そこで,我々は,上述のラマン分光法を用いて,II型肺胞上皮様細胞(A549)にPM2.5の代表的存在ともいえるDEPを曝露し,細胞内に局在するDEPを三次元的に可視化することに成功した(図8).この手法によって,環境中微粒子を標識せず,環境中微粒子の性質や分子量を変えることなく,粒子そのものの細胞内動態の可視化が可能となった.さらに,従来,核や細胞骨格等の染色が行われていたが,核および細胞質由来の物質をラマン分光法によって検出することで,非染色下で環境中微粒子の細胞内局在が,より詳細に解析できるようになった.今後,本技術をさらに発展させ,環境中微粒子と生体内分子との関連の解明が望まれる.