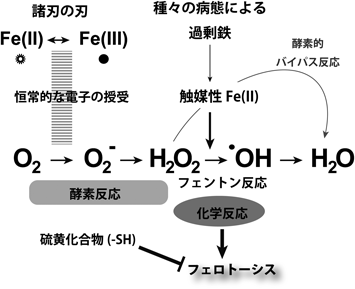
ビッグバンにより宇宙の膨張が始まったのは138億年前,地球ができたのが46億年前,原初の海の中で最初の生命体が生まれたのは38億年前と考えられている1, 2).今のところ,鉄なしで生存できる独立した生命体は地球上では知られていない3).鉄はヒトにおいて最も多く含まれる遷移金属(redox-active)であり,Fe(II),Fe–Sクラスターあるいはヘムのかたちでさまざまな酸化還元(電子伝達)反応に利用されている4).進化の過程で生命体は,この過剰鉄で発生する鉄毒性に対抗するためにグルタチオンに代表されるスルフヒドリル(SH)系を獲得した5).これは最初ただ単に不溶性のFeSであったのかもしれない6, 7).そして,その後,生命体は分子状酸素を使用する能力を獲得するに至った.酸素分子は4電子還元を受けて水になる性質を有するため,1~4電子の柔軟性や弾力性の高い高度な電子のやりとりが可能となったのである(図1)8).
酸素を組み込んだ代謝が始まると,必ず活性酸素(reactive oxygen species:ROS)が発生することとなる.スーパーオキシドと過酸化水素は酵素的に生成するが,ヒドロキシルラジカルはフェントン反応(Fe[II]+H2O2→Fe[III]+•OH+OH−)と呼ばれる化学反応により発生する9–11).触媒性Fe(II)は裸で存在すると生命にとって危険な存在である.現在,この触媒性Fe(II)をturn-offあるいはturn-onの蛍光プローブで可視化することが可能となっている12–14).幸運なことに,我々の細胞にはこの鉄毒性を最小限にするような精緻な分子機構が多数備わっているのである.
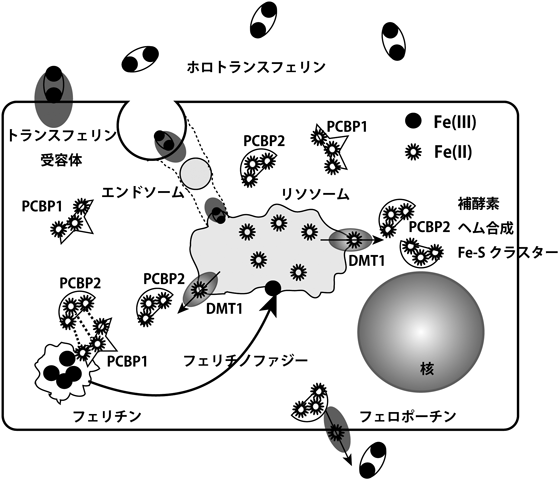
我々は鉄の利点を最大限に利用している.Fe(II)は中性で,ある程度可溶性であるが,Fe(III)はまったく溶けない11).高等動物においては,鉄はトランスフェリンによってFe(III)として輸送される15).Fe(III)はDMT1(SLC11A2)16)やフェロポーチン(SLC40A1)17)などのトランスポーターで膜を通過するときには,還元され必ずFe(II)になっている.十二指腸粘膜からの鉄の吸収は全身の鉄貯蔵の状態により厳密に制御されている18).細胞内で過剰な鉄はサイトゾルにおいて,Fe(III)のかたちでフェリチンとして貯蔵されている.さらに,最近,サイトゾルにおける鉄の輸送に関するシャペロン分子が同定された(図2).このシャペロン分子はpoly rC binding protein 1/2(PCBP1/2)であるが,もともとは転写制御に関わる核内タンパク質として報告されていたものである.PCBP1/2はいずれも3分子のFe(II)を結合できるが,その複合体に触媒活性はない19, 20).PCBP2はDMT121)やheme oxygenase 122)からFe(II)を受け取り,フェロポーチンに渡すことができるのに対して23),PCBP1はフェリチン24量体にFe(II)を搭載できる24)とされている.PCBP1とPCBP2は互いに拮抗しているが,これまでの報告では一般的にPCBP1はがん抑制遺伝子の要素が強く25, 26),PCBP2はがん遺伝子の側面が強い27, 28)とされる.フェリチン24量体は内部に4200分子ものFe(III)を貯蔵できるが,最近,フェリチンからの鉄の取り出し方もわかってきた.NCOA4をアダプター分子とするオートファジーの一種であるフェリチノファジーがその分子機構であり,リソソーム内でFe(III)はSTEAP3により再びFe(II)に還元される29).
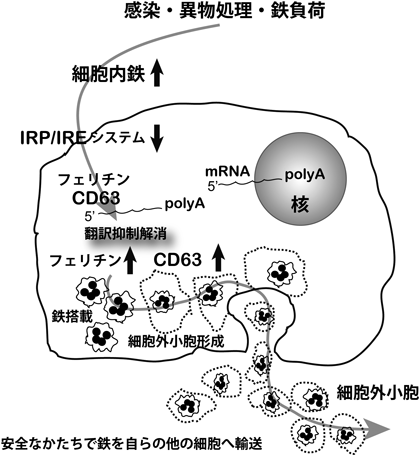
フェリチンは24サブユニットよりなるナノケージタンパク質であり,軽鎖と重鎖からなり,iron regulatory protein(IRP)/iron-responsive element(IRE)転写後調節機構による制御のもとに,鉄をFe(III)として安全なかたちで貯蔵している.フェリチンはまた,マクロファージをはじめとする細胞から分泌もされていることが知られ,体内の鉄貯蔵状態を最もよく反映する血清マーカーであり30),ヒトの臨床でも使用されている.しかしながら,フェリチン遺伝子には分泌シグナルがないため,どのような機構で細胞外に分泌されているのかは長い間不明であった31).最近,我々は初めて細胞外小胞(extracellular vesicle:EV)であるエクソソームの代表的な分子マーカーCD63が,上記鉄代謝に特異的なIRP/IRE系に制御されていることを発見した(図3)32).細胞に鉄が十分あるときには,NCOA4をアダプターとして鉄を搭載したフェリチン24量体がEV内に導かれ,EVとして分泌されているのである.その受容体はまだわかっていないが,このシステムは同一個体内の細胞間で安全なかたちで鉄をやりとりする方法と考えられる.CD63遺伝子におけるIRE配列はほとんどの霊長類では確認できたが,すべての哺乳類では確認されず,進化的に大きな意味を有する可能性がある.
高等動物における鉄代謝は,いったん,十二指腸から吸収されてしまうと半閉鎖系となっている.たとえば成人男子は4000 mg程度,成人女子は2500 mg程度の鉄を有するが,1日の出入りはきわめて微量であり,1 mg程度である.鉄には積極的な排泄系はなく,これは進化的に鉄の獲得がいかに重要であったかを意味していると考えられる33).鉄を体外まで排出する限られた方法は出血,あるいはdesferal, deferasiroxやdeferiproneといった鉄キレート剤の使用であり34),あとは皮膚や消化管の上皮細胞の剥離に伴うものとなる.したがって,老化に伴いからだの代謝率が下がってくると,相対的な鉄過剰が起こることは想像にかたくない.実際,ラットにおける包括的研究によると,腎臓,卵巣,子宮などいろいろな臓器で年齢依存性にフェロトーシスを起こした細胞が増加している35).
過剰鉄は発がんと関係している.これにはヒトの全般的な疫学データ,ヒトの遺伝性ヘモクロマトーシスや卵巣の子宮内膜症など特定の鉄過剰を来す疾患に関するデータ36–38),そして動物実験の多数のデータがある4, 39).その分子機構は,1)過剰鉄は最終的にサイトゾルの触媒性Fe(II)を増やし,そのために発生する化学反応であるフェントン反応が核内DNAを傷害して変異を起こすこと40, 41),ならびに2)鉄は,Fe(II),Fe–Sクラスターあるいはヘムとして種々の細胞増殖に関わる酵素の補因子になっていることである4, 10, 33, 42, 43).
発がんには原因がはっきりしているものと,はっきりとはわからないものがある.原因がはっきりしているものの中に,アスベスト繊維(石綿)があり,悪性中皮腫や肺がんのリスクであることが確立されている44, 45).アスベスト繊維は熱・酸・摩擦に強く,鉱山において掘り出せば容易に多量に手に入るという経済的メリットにより前世紀に多量に使用された.アスベスト繊維は,採掘する鉱山の坑夫のみならず,アスベストを材料として使用する工場の労働者,さらにマスク・衣料や機関車などの最終製品を使用したヒトにおいても曝露が観察されることとなった.天然のナノ繊維性鉱物であるアスベストは,残念なことに日本と韓国以外のアジア諸国,ロシア,ブラジルなどにおいていまだに産業的に使用されている.これは主として代替品のグラスファイバーなどが高価であるためである.1987年に世界保健機関(WHO)の国際がん研究機関(IARC)はすべてのアスベストはヒトに発がん性があると宣言している44).日本においても,いわゆる「クボタショック」が起こるまでは白石綿(クリソタイル)は野放しであったが,2006年にようやくすべてのアスベスト繊維が使用禁止となっている.その上に,悪性中皮腫と病理的に診断された場合には国の責任を認め,石綿健康被害救済制度によりすべての患者あるいはその家族に手厚い給付金を出している.とはいっても,古い建物などいまだにアスベストを含む場合もあり,曝露源がゼロになったわけではない.
空気中を舞うアスベストを吸入することによりなぜ中皮腫が発生するかに関しては,長い間謎であった46, 47).今ではその鉱物線維の3次元的な大きさ・かたちと生体内での耐久性が鍵となることがわかっているが,科学的なデータを撹乱するためのアスベスト産業の工作があったこともわかっている48).そうしたことから現在ではすべての科学研究においては,Conflict of Interest(COI)を明らかにすることとなっている.一時はポリオワクチンに含まれたSV40が原因であるとか,アスベスト繊維は放射能を放出するウランを吸着しやすい等,諸説が出たが,いずれも少なくとも主たる病因ではないことがわかっている.
現在,がんはゲノムの改変(変異)の病気であると理解される.アスベスト繊維はその物理的な性質のため気道から肺胞腔まで到達することができる.そこで,肺胞マクロファージに貪食されるが,マクロファージは,自らの直径より長くまた数十~数百nmオーダーのきわめて細い繊維は処理できずに,結局フェロトーシスで死ぬこととなる.このメカニズムは1970年代からfrustrated phagocytosisと呼ばれ,注目されていた.つまり,マクロファージはアスベスト繊維をうまく処理できないためフラストレーションに陥って周囲に活性酸素をまき散らすことになる49).アスベスト繊維は鉱物であるため簡単には分解されずその場に残されるが,肺が均一に広がるために胸腔は陰圧になっており,そのため少しずつ胸壁の方へ向かって遠位に動いていくことになる.そして,20~30年を要して,臓側胸膜を突き破って,壁側胸膜に到達するのである47, 50).この胸膜の表面の一層の扁平な細胞が中皮細胞であり,アスベスト繊維による発がんの主な標的細胞である.中皮細胞は心嚢腔や腹腔も被覆している.中皮細胞は,中胚葉由来の細胞であって,その主たる存在意義はヒアルロン酸を分泌することによって体腔の中で常時動いている肺や心臓,腸管などの臓器の摩擦を減ずることである.我々はこれまでの10年以上にわたる研究により,主に使用されてきた3種類のアスベスト繊維はどれも特異的タンパク質,特にヘモグロビンとヒストン,を吸着することを明らかにした.ならびに,中皮細胞が一種の貪食細胞でもあることこそが,発がんに至る重要な分子メカニズムの一つであると考えている51).
つまり,アスベスト繊維の表面が酸化的な反応のニッチになると考えている52).アスベスト繊維は何十年もかかって肺内を通過するうちに,フェロトーシスを起こして壊死する,鉄を集めたマクロファージや,白石綿に触れて溶血する赤血球のヘモグロビンから,鉄を回収して回るのである.そして,胸腔に到達して,壁側の中皮細胞に貪食されるときに中皮細胞に酸化的傷害とゲノムの変異を起こすと考えられる.
この際,悪性中皮腫で最も頻度の高い変異は,ヒト53)でもラットモデル54)でもp16INK4Aがん抑制遺伝子であり,そのホモ欠損である.p16INK4Aがん抑制遺伝子はゲノムの一つの要の部位であり,選択的スプライシングによりP16以外にARFというタンパク質に翻訳され,それぞれ,細胞周期のブレーキあるいはP53特異的なユビキチンリガーゼのインヒビターの役割をしている.このゲノム部位のホモ欠損により,細胞周期にはブレーキがかからず,DNA傷害を受けた細胞もアポトーシスを起こすことができなくなるのである.このp16INK4Aがん抑制遺伝子という標的遺伝子が,フェントン反応の反復によるラット腎がんモデルのそれと一致している41)のは,過剰鉄を病態とする発がんの一つの証拠とも考えられる55).
このように病態が局所の鉄過剰ということになると,除鉄で予防ができないかという話になる.これに関しては,少なくとも動物モデルにおける前臨床レベルでは成功を収めている.一つは鉄キレート剤,deferasiroxを使用したものであり56),もう一つは瀉血によるものである57).どちらにおいても,動物の生存期間の延長,腫瘍の体積の減少あるいは悪性度の高い肉腫型の割合の減少が認められた.症状も何もない人に副作用があるかもしれない薬剤をずっと飲んでいただくのは倫理的に問題があるので,現実的には定期的な瀉血あるいは献血が社会実装としてとるべき手段であろうかと考えている.
また,アスベスト繊維に対するのときわめて類似した現象が,動物実験レベルで人工的な合成産物であるカーボンナノチューブで認められる.我々はその発がん性に関して,多層カーボンナノチューブにおいて,直径50 nm程度のものの中皮腫発がん性が高いことを報告した52, 58).現在は,直径50 nmの多層カーボンナノチューブはIARCでGroup 2Bに分類されている.
6. アスベスト誘発フェロトーシスの副産物としてのフェリチン分泌
前節では,アスベストによる中皮腫発がんの分子機構としてあくまで中皮細胞に主に着目していた.しかしながら,最近,我々はアスベストを処理しようとして最終的フェロトーシスに陥る炎症細胞,マクロファージも中皮細胞の発がんに関与していることを見いだした59).90年代には能動的な細胞死アポトーシスと受動的な細胞死ネクローシス(壊死)しか認識されておらず,理解は単純であった.この概念自体は,形態学的には現在でも有効であるが,細胞死の種類は少なくとも12には分類されており,その一つが,金床がトレードマークとなっているフェロトーシス(ferroptosis)である60).フェロは二価鉄,トーシスは剥がれ落ちるということを意味する.2012年に初めて提唱された細胞死であるが,現在,フェロトーシスを扱う論文はうなぎ登りに増えており,研究者の関心がきわめて高いことをうかがわせている61).フェロトーシスの定義は「触媒性二価鉄依存性の制御性壊死であり脂質過酸化を伴うもの」であるが,最近の理解は「鉄と硫黄(抗酸化)のせめぎ合いで,鉄の方が有意になったもの」とも考えることができる8, 47).
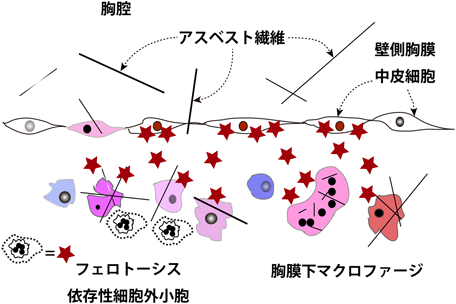
我々のからだの中で,マクロファージは骨髄で産生される単球が血管外で分化した貪食細胞であり,免疫系の細胞の要と考えられている.壁側の胸膜に到着したアスベスト繊維は直接中皮細胞に傷害を与えるのみならず,その大半は異物を貪食するマクロファージに取り込まれ,肉芽腫を形成する.このようにしてマクロファージは異物を生体から切り離そうとするが,一部のマクロファージはフェロトーシスで死んでいく.その際に,我々はフェロトーシスを起こしているマクロファージからEVが放出されることを見いだした(図4).そして,それを詳細に解析していくとそのEVには,鉄を充填されたフェリチンが多量に入っていることが判明した.しかも,このEVは胸膜表面の中皮細胞に取り込まれ,中皮細胞のゲノムDNAに酸化的な傷害を起こし,DNAの二本鎖切断も起こしていたのである62).これはすなわち,アスベスト繊維は直接的に中皮細胞の発がんに寄与するのみならず,マクロファージを介して間接的にも発がんに寄与することを意味しているのである.
近年,内因性細胞外微粒子である細胞外小胞と,外因性細胞外微粒子であるアスベストなど繊維性ナノマテリアルのリンクが初めて明らかとなった.その要は鉄代謝であった.細胞外小胞の代表的な分子マーカーCD63遺伝子の5′非翻訳領域に鉄代謝の特徴的なIRE配列が存在し,実際に機能しているのが確認された.フェリチンは鉄が十分にあるときには鉄搭載状態で細胞外小胞の内容物として分泌されていることが明らかになった.同様の現象は,アスベスト曝露でフェロトーシスを起こしているマクロファージでも起こるが,この場合は図らずも発がんに寄与するのである.生命は,細胞外微粒子をうまく利用しながら鉄を自らの個体のみで独占する仕組みを進化させてきたのであろう.
引用文献References
1) Olson, K.R. & Straub, K.D. (2016) The role of hydrogen sulfide in evolution and the evolution of hydrogen sulfide in metabolism and signaling. Physiology (Bethesda), 31, 60–72.
2) Gualtieri, A.F., Andreozzi, G.B., Tomatis, M., & Turci, F. (2018) Iron from a geochemical viewpoint. Understanding toxicity/pathogenicity mechanisms in iron-bearing minerals with a special attention to mineral fibers. Free Radic. Biol. Med., 133, 21–37.
3) Knoll, A.H. & Nowak, M.A. (2017) The timetable of evolution. Sci. Adv., 3, e1603076.
4) Toyokuni, S., Kong, Y., Cheng, Z., Sato, K., Hayashi, S., Ito, F., Jiang, L., Yanatori, I., Okazaki, Y., & Akatsuka, S. (2020) Carcinogenesis as side effects of iron and oxygen utilization: From the unveiled truth toward ultimate bioengineering. Cancers (Basel), 12, 3320.
5) Sies, H. (1999) Glutathione and its role in cellular functions. Free Radic. Biol. Med., 27, 916–921.
6) Posfai, M., Buseck, P.R., Bazylinski, D.A., & Frankel, R.B. (1998) Reaction sequence of iron sulfide minerals in bacteria and their use as biomarkers. Science, 280, 880–883.
7) Schippers, A. & Jorgensen, B.B. (2002) Biogeochemistry of pyrite and iron sulfide oxidation in marine sediments. Geochim. Cosmochim. Acta, 66, 85–92.
8) Toyokuni, S., Yanatori, I., Kong, Y., Zheng, H., Motooka, Y., & Jiang, L. (2020) Ferroptosis at the crossroads of infection, aging and cancer. Cancer Sci., 111, 2665–2671.
9) Fenton, H.J.H. (1894) LXXIII.—Oxidation of tartaric acid in presence of iron. J. Chem. Soc., 65, 899–910.
10) Toyokuni, S. (1996) Iron-induced carcinogenesis: the role of redox regulation. Free Radic. Biol. Med., 20, 553–566.
11) Koppenol, W.H. & Hider, R.H. (2019) Iron and redox cycling. Do’s and don’ts. Free Radic. Biol. Med., 133, 3–10.
12) Hirayama, T., Okuda, K., & Nagasawa, H. (2013) A highly selective turn-on fluorescent probe for iron(ii) to visualize labile iron in living cells. Chem. Sci. (Camb.), 4, 1250–1256.
13) Mukaide, T., Hattori, Y., Misawa, N., Funahashi, S., Jiang, L., Hirayama, T., Nagasawa, H., & Toyokuni, S. (2014) Histological detection of catalytic ferrous iron with the selective turn-on fluorescent probe RhoNox-1 in a Fenton reaction-based rat renal carcinogenesis model. Free Radic. Res., 48, 990–995.
14) Hirayama, T. (2019) Fluorescent probes for the detection of catalytic Fe(II) ion. Free Radic. Biol. Med., 133, 38–45.
15) Kawabata, H. (2019) Transferrin and transferrin receptors update. Free Radic. Biol. Med., 133, 46–54.
16) Yanatori, I. & Kishi, F. (2019) DMT1 and iron transport. Free Radic. Biol. Med., 133, 55–63.
17) Ganz, T. (2019) Erythropoietic regulators of iron metabolism. Free Radic. Biol. Med., 133, 69–74.
18) Gunshin, H., Mackenzie, B., Berger, U., Gunshin, Y., Romero, M., Boron, W., Nussberger, S., Gollan, J., & Hediger, M. (1997) Cloning and characterization of a mammalian proton-coupled metal-ion transporter. Nature, 388, 482–488.
19) Philpott, C.C. & Jadhav, S. (2019) The ins and outs of iron: Escorting iron through the mammalian cytosol. Free Radic. Biol. Med., 133, 112–117.
20) Yanatori, I., Richardson, D.R., Toyokuni, S., & Kishi, F. (2020) The new role of poly (rC)-binding proteins as iron transport chaperones: Proteins that could couple with inter-organelle interactions to safely traffic iron. Biochim. Biophys. Acta, Gen. Subj., 1864, 129685.
21) Yanatori, I., Yasui, Y., Tabuchi, M., & Kishi, F. (2014) Chaperone protein involved in transmembrane transport of iron. Biochem. J., 462, 25–37.
22) Yanatori, I., Richardson, D.R., Toyokuni, S., & Kishi, F. (2017) The iron chaperone poly(rC)-binding protein 2 forms a metabolon with the heme oxygenase 1/cytochrome P450 reductase complex for heme catabolism and iron transfer. J. Biol. Chem., 292, 13205–13229.
23) Yanatori, I., Richardson, D.R., Imada, K., & Kishi, F. (2016) Iron Export through the Transporter Ferroportin 1 Is Modulated by the Iron Chaperone PCBP2. J. Biol. Chem., 291, 17303–17318.
24) Shi, H.F., Bencze, K.Z., Stemmler, T.L., & Philpott, C.C. (2008) A cytosolic iron chaperone that delivers iron to ferritin. Science, 320, 1207–1210.
25) Guo, J. & Jia, R. (2018) Splicing factor poly(rC)-binding protein 1 is a novel and distinctive tumor suppressor. J. Cell. Physiol., 234, 33–41.
26) Zhang, Y., Meng, L., Xiao, L., Liu, R., Li, Z., & Wang, Y.L. (2018) The RNA-binding protein PCBP1 functions as a tumor suppressor in prostate cancer by inhibiting mitogen activated protein kinase 1. Cell. Physiol. Biochem., 48, 1747–1754.
27) Chen, C., Lei, J., Zheng, Q., Tan, S., Ding, K., & Yu, C. (2018) Poly(rC) binding protein 2 (PCBP2) promotes the viability of human gastric cancer cells by regulating CDK2. FEBS Open Bio, 8, 764–773.
28) Wang, X., Guo, Q., Wang, H., Yuan, X., Wang, B., Lobie, P.E., Zhu, T., Tan, S., & Wu, Z. (2021) PCBP2 Posttranscriptional modifications induce breast cancer progression via upregulation of UFD1 and NT5E. Mol. Cancer Res., 19, 86–98.
29) Mancias, J.D., Wang, X.X., Gygi, S.P., Harper, J.W., & Kimmelman, A.C. (2014) Quantitative proteomics identifies NCOA4 as the cargo receptor mediating ferritinophagy. Nature, 509, 105–109.
30) Wish, J.B. (2006) Assessing iron status: beyond serum ferritin and transferrin saturation. Clin. J. Am. Soc. Nephrol., 1(Suppl 1), S4–S8.
31) Truman-Rosentsvit, M., Berenbaum, D., Spektor, L., Cohen, L.A., Belizowsky-Moshe, S., Lifshitz, L., Ma, J., Li, W., Kesselman, E., Abutbul-Ionita, I., et al. (2018) Ferritin is secreted via 2 distinct nonclassical vesicular pathways. Blood, 131, 342–352.
32) Yanatori, I., Richardson, D.R., Dhekne, H.S., Toyokuni, S., & Kishi, F. (2021) CD63 is regulated by iron via the IRE-IRP system and is important for ferritin secretion by extracellular vesicles. Blood, 138, 1490–1503.
33) Toyokuni, S. (2009) Role of iron in carcinogenesis: cancer as a ferrotoxic disease. Cancer Sci., 100, 9–16.
34) Mobarra, N., Shanaki, M., Ehteram, H., Nasiri, H., Sahmani, M., Saeidi, M., Goudarzi, M., Pourkarim, H., & Azad, M. (2016) A review on iron chelators in treatment of iron overload syndromes. Int. J. Hematol. Oncol. Stem Cell Res., 10, 239–247.
35) Zheng, H., Jiang, L., Tsuduki, T., Conrad, M., & Toyokuni, S. (2021) Embryonal erythropoiesis and aging exploit ferroptosis. Redox Biol., 48, 102175.
36) Mori, M., Ito, F., Shi, L., Wang, Y., Ishida, C., Hattori, Y., Niwa, M., Hirayama, T., Nagasawa, H., Iwase, A., et al. (2015) Ovarian endometriosis-associated stromal cells reveal persistently high affinity for iron. Redox Biol., 6, 578–586.
37) Kajiyama, H., Suzuki, S., Yoshihara, M., Tamauchi, S., Yoshikawa, N., Niimi, K., Shibata, K., & Kikkawa, F. (2019) Endometriosis and cancer. Free Radic. Biol. Med., 133, 186–192.
38) Hayashi, S., Nakamura, T., Motooka, Y., Ito, F., Jiang, L., Akatsuka, S., Iwase, A., Kajiyama, H., Kikkawa, F., & Toyokuni, S. (2020) Novel ovarian endometriosis model causes infertility via iron-mediated oxidative stress in mice. Redox Biol., 37, 101726.
39) Torti, S.V., Manz, D.H., Paul, B.T., Blanchette-Farra, N., & Torti, F.M. (2018) Iron and cancer. Annu. Rev. Nutr., 38, 97–125.
40) Toyokuni, S. (2006) Novel aspects of oxidative stress-associated carcinogenesis. Antioxid. Redox Signal., 8, 1373–1377.
41) Akatsuka, S., Yamashita, Y., Ohara, H., Liu, Y.T., Izumiya, M., Abe, K., Ochiai, M., Jiang, L., Nagai, H., Okazaki, Y., et al. (2012) Fenton reaction induced cancer in wild type rats recapitulates genomic alterations observed in human cancer. PLoS One, 7, e43403.
42) Toyokuni, S. (2016) The origin and future of oxidative stress pathology: From the recognition of carcinogenesis as an iron addiction with ferroptosis-resistance to non-thermal plasma therapy. Pathol. Int., 66, 245–259.
43) Toyokuni, S., Ito, F., Yamashita, K., Okazaki, Y., & Akatsuka, S. (2017) Iron and thiol redox signaling in cancer: An exquisite balance to escape ferroptosis. Free Radic. Biol. Med., 108, 610–626.
44) IARC, W. (2012) IARC Monographs on the evaluation of carcinogenic risks to humans. A Review of Human Carcinogens; Part C: Arsenic, Metals, Fibres, and Dusts, 100C, 219–309.
45) Oury, T.D., Sporn, T.A., & Roggli, V.L.(2014) Pathology of Asbestos-associated Diseases, 3rd ed., Springer Verlag.
46) Toyokuni, S. (2009) Mechanisms of asbestos-induced carcinogenesis. Nagoya J. Med. Sci., 71, 1–10.
47) Toyokuni, S. (2019) Iron addiction with ferroptosis-resistance in asbestos-induced mesothelial carcinogenesis: Toward the era of mesothelioma prevention. Free Radic. Biol. Med., 133, 206–215.
48) Editorial, N. (2010) Asbestos scandal. Nature, 468, 868.
49) Stanton, M.F. & Wrench, C. (1972) Mechanisms of mesothelioma induction with asbestos and fibrous glass. J. Natl. Cancer Inst., 48, 797–821.
50) Toyokuni, S., Ito, F., & Motooka, Y. (2021) Role of ferroptosis in nanofiber-induced carcinogenesis. Metallomics Research, 1, 14–21.
51) Nagai, H., Ishihara, T., Lee, W.H., Ohara, H., Okazaki, Y., Okawa, K., & Toyokuni, S. (2011) Asbestos surface provides a niche for oxidative modification. Cancer Sci., 102, 2118–2125.
52) Nagai, H. & Toyokuni, S. (2012) Differences and similarities between carbon nanotubes and asbestos fibers during mesothelial carcinogenesis: shedding light on fiber entry mechanism. Cancer Sci., 103, 1378–1390.
53) Xio, S., Li, D., Vijg, J., Sugarbaker, D.J., Corson, J.M., & Fletcher, J.A. (1995) Codeletion of p15 and p16 in primary malignant mesothelioma. Oncogene, 11, 511–515.
54) Jiang, L., Akatsuka, S., Nagai, H., Chew, S.H., Ohara, H., Okazaki, Y., Yamashita, Y., Yoshikawa, Y., Yasui, H., Ikuta, K., et al. (2012) Iron overload signature in chrysotile-induced malignant mesothelioma. J. Pathol., 228, 366–377.
55) Toyokuni, S. (2011) Mysterious link between iron overload and CDKN2A/2B. J. Clin. Biochem. Nutr., 48, 46–49.
56) Nagai, H., Okazaki, Y., Chew, S.H., Misawa, N., Yasui, H., & Toyokuni, S. (2013) Deferasirox induces mesenchymal-epithelial transition in crocidolite-induced mesothelial carcinogenesis in rats. Cancer Prev. Res. (Phila.), 6, 1222–1230.
57) Ohara, Y., Chew, S.H., Shibata, T., Okazaki, Y., Yamashita, K., & Toyokuni, S. (2018) Phlebotomy as a preventive measure for crocidolite-induced mesothelioma in male rats. Cancer Sci., 109, 330–339.
58) Nagai, H., Okazaki, Y., Chew, S., Misawa, N., Yamashita, Y., Akatsuka, S., Yamashita, K., Ishihara, T., Yoshikawa, Y., Jiang, L., et al. (2011) Diameter and rigidity of multiwalled carbon nanotubes are critical factors in mesothelial injury and carcinogenesis. Proc. Natl. Acad. Sci. USA, 108, E1330–E1338.
59) Ito, F., Yanatori, I., Maeda, Y., Nimura, K., Ito, S., Hirayama, T., Nagasawa, H., Kohyama, N., Okazaki, Y., Akatsuka, S., et al. (2020) Asbestos conceives Fe(II)-dependent mutagenic stromal milieu through ceaseless macrophage ferroptosis and β-catenin induction in mesothelium. Redox Biol., 36, 101616.
60) Galluzzi, L., Vitale, I., Aaronson, S.A., Abrams, J.M., Adam, D., Agostinis, P., Alnemri, E.S., Altucci, L., Amelio, I., Andrews, D.W., et al. (2018) Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death Differ., 25, 486–541.
61) Stockwell, B.R., Friedmann Angeli, J.P., Bayir, H., Bush, A.I., Conrad, M., Dixon, S.J., Fulda, S., Gascon, S., Hatzios, S.K., Kagan, V.E., et al. (2017) Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell, 171, 273–285.
62) Ito, F., Kato, K., Yanatori, I., Murohara, T., & Toyokuni, S. (2021) Ferroptosis-dependent extracellular vesicles from macrophage contribute to asbestos-induced mesothelial carcinogenesis through loading ferritin. Redox Biol., 47, 102174.