2. EVの発展的利用を可能とするEVのエンジニアリング
1)EVへの機能性カーゴローディング
高い生体適合性,血液脳関門透過性などの優れた特性から,DDSキャリアとして注目を集めるEVであるが,EV産生細胞を改変することで,EVに搭載する分子をさまざまに制御することが可能である.まずは,EVに特定の分子を内包し(以後この内包した分子をカーゴと呼ぶ),このカーゴを効率的に送達するためのEVの機能化戦略について紹介する.
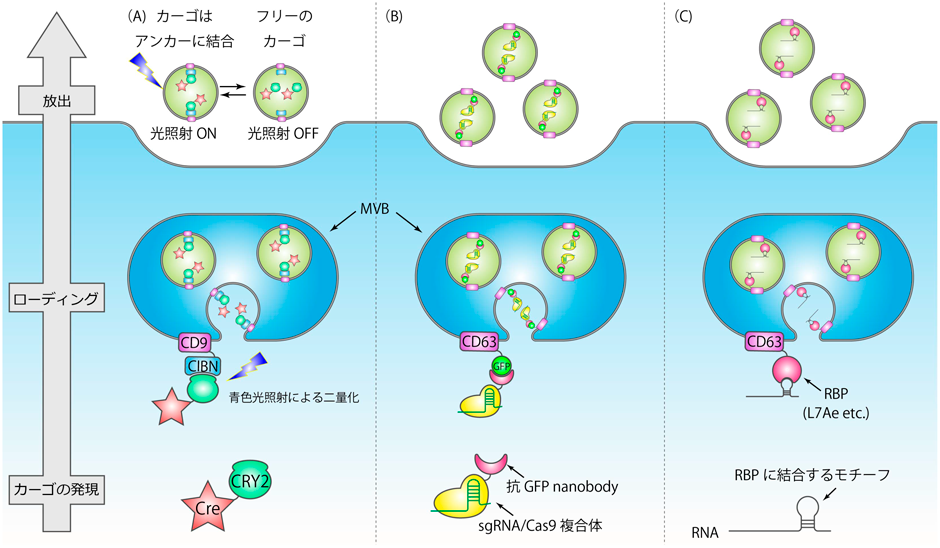
一般的に,EVの典型的なマーカーであるCD63やCD9といったテトラスパニンの末端に,EV内に封入したいタンパク質(カーゴタンパク質)を融合して発現することで,このカーゴタンパク質をEV内に積極的に封入することが可能であるが,EVを受領した細胞内でこれを機能させるには,カーゴタンパク質を,EVへの“アンカー”として利用するマーカータンパク質(以下アンカーと呼ぶ)と共有結合していないsolubleな形で封入する必要がある.この目的に向け,Yimらは,光二量化タンパク質を用いたタンパク質封入系を開発した1)(図1A).彼らは,CD9のN末端(EV内腔を向く)にCIBNを,カーゴタンパク質にCRY2を融合してHEK293T細胞に発現した.青色照射下ではアンカーに融合したCIBNとカーゴに融合したCRY2が相互作用するため,カーゴタンパク質が積極的にEV内にロードされるが,カーゴタンパク質がEV内に封入された後に,青色光を切ることで,カーゴをアンカーから切り離されたsolubleな形としてEVに封入することが可能になる.デモンストレーションとして,Creタンパク質を封入することで,in vivoで組換えを引き起こせることが示されている.
共有結合でない相互作用でカーゴタンパク質をEV内に封入する別の方法として,nanobodyを利用した方法も報告されている.YeらはCD63にGFPを融合して発現し,別途Cas9に抗GFP nanobodyを融合したタンパク質をguide RNAと共発現することで,GFPと抗GFP nanobodyの相互作用を利用して,Cas9-gRNAのribonucleoprotein complexをEV内に効率的に導入できることを示している(図1B)2).このシステムによって改変されたEVは,受領細胞内において実際にゲノム編集を引き起こすことができることが示されている.
アンカータンパク質との相互作用を適切に設定することで,特定のmRNAをEV内に積極的に封入することも可能である.我々は,CD63に古細菌由来のRNA結合タンパク質(RNA binding protein:RBP)であるL7Aeを融合して発現し,一方で封入したいmRNAの3′非翻訳領域に,L7Aeと結合するRNAモチーフであるC/Dboxを導入して発現することで,望むmRNAを効率的にEV内に封入できることを示した(図1C)3).このような,RBPとそれに結合するRNAモチーフの組合わせを利用したEV内へのRNAローディング法は,これまでに複数報告されており,たとえば,MS2-MS2boxの相互作用4),HuR-miR-155の相互作用5),TAT-TARの相互作用6)を利用した系などが報告されている.
2)カーゴ送達を効率化する手法とその応用
ロードしたカーゴをターゲット細胞に効率的に送達するには,EVのターゲティングや,EVの内容物をターゲット細胞の細胞質内に効率的に送達するような仕掛けも重要である.ターゲティングに関しては,代表的なものとして,EVに発現するタンパク質であるLamp2bをscaffoldに使用したものがあげられる.脳内の神経細胞に発現するCHRNA7に結合するRVGペプチドをLamp2bの細胞外ドメインに導入して発現することで,siRNAを電気穿孔法によって封入したEVを脳に効率的に送達できることが報告されている7).この他にも,GPIアンカーやLactadherinのC1C2ドメインなどを利用して,nanobodyや一本鎖抗体などをEV上に提示することで,これが結合する受容体をターゲットとしたEV送達が可能になることが報告されている8).
受領細胞に取り込まれたEVの多くはエンドソームに運ばれ,そのまま分解されてしまうことも多いため,効率的なカーゴ分子の送達を行うには,内容物のエンドソーム脱出を補助するようなタンパク質を併用することが効果的である.代表的なものとしては,酸性環境で膜融合を促進するfusogenic proteinであるVSV-Gがあげられる.VSV-Gを高発現したEVを用いることで,CreやCas9といったゲノム編集を引き起こせるタンパク質を効率的に細胞に送達できることが示されている9, 10)(両論文とも,アンカーにVSV-G自身を用い,split GFPのフラグメントどうしの相互作用7)や,FKBPとFRBの小分子薬剤添加に伴う相互作用を利用して積極的なカーゴローディングを達成している8)).また,我々は,上述のCD63-L7Aeを用いたRNA送達系において,EV放出細胞にギャップ結合をつかさどるCx43の恒常的活性化型(CA)を発現させることで,効率よくEV内のRNAを受領細胞に送達可能であることを示した3).
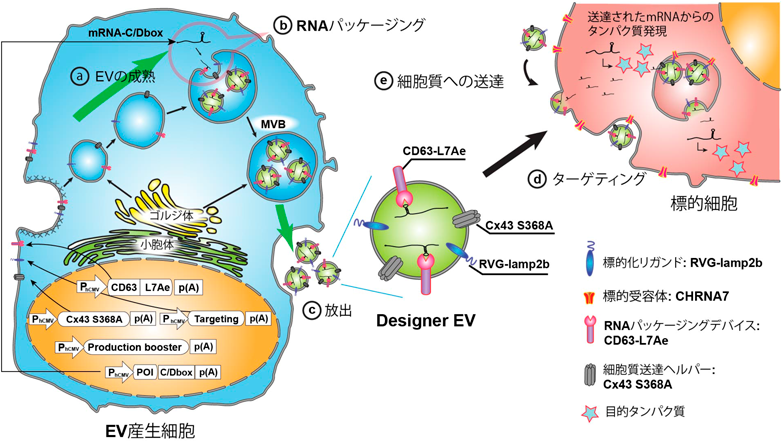
このようなカーゴ分子効率的送達系は,発揮したい機能に応じてカーゴを適切に選択することで,さまざまな疾患治療系に応用することが可能である.たとえば,RNA送達に関して,我々は,上述のCD63-L7Aeを用いたRNA封入系,RVG-Lamp2bを用いた神経細胞へのターゲティング,ターゲット細胞の細胞質へのRNA送達の補助薬としてのCx43 CAに加えて,EVの産生自体をブーストするコンポーネント(STEAP3, SDC4, NadBフラグメントを共発現するカセット)を併用することで,catalase mRNAを含むEVを効率的に産生できる細胞を創出した(このデバイス群を総称してEXOtic deviceと呼称している)(図2).これを動物個体内に埋め込むことで,EVを介してcatalase mRNAを神経細胞に送達し,パーキンソン病で問題となる脳内の炎症を抑えることができることを示した3).また,ほぼ同様のEXOtic deviceを用いたシステムで,HIV-1 repressor protein(HIVのプロモーター領域を標的にしたZnフィンガータンパク質と,DNAメチルトランスフェラーゼの融合タンパク質)をコードするmRNAを免疫細胞に送達することで,HIV-1を治療しうることも報告されている11).Proof of conceptのレベルでは,EVを介したCRISPRの送達系も疾患治療に利用可能なことも示唆されてきており10),適切なカーゴの選択・選択的な送達法のさらなる開発によって,さまざまな疾患治療法が開発されていくことが期待される.
3)分子提示による機能発揮を指向したEVのエンジニアリング
ここまで,EVを介したカーゴ送達について紹介してきたが,EVは表面に提示した分子を通じたダイレクトな機能発揮も可能である.特に注目を集めているのが,機能改変したEVを用いた免疫のmodulationである.たとえば,Shiらは,T細胞上に発現するCD3と,乳がんなどのがん細胞上に発現する抗原であるHER2をそれぞれ認識する一本鎖抗体をタンデムに連結したタンパク質を,PDGFRの膜貫通ドメインを利用してEV上に提示した“SMART-Exo”を報告している12).このEVは,細胞障害性T細胞をHER2陽性のがん細胞に対してリクルートし,活性化することで,顕著な抗腫瘍効果を発揮することが報告されている.一方,Kimらは,改変したVSV-Gを提示したEVを利用してがん細胞を“xenogenize”(異種化)することで,抗腫瘍免疫を増強することを報告している13).彼らは,がん細胞周辺の弱酸性環境(pH 6.5~7.1, VSV-Gが本来膜融合を発揮するpHよりも若干塩基性)で膜融合を引き起こすことができるよう,VSV-Gに点変異を導入した.これをEV上に発現して投与することで,がん細胞に選択的にVSV-Gを発現させるような“membrane editing”を引き起こすことで,免疫システムにがん細胞を異種として認識させ,顕著な抗腫瘍効果を発揮することに成功している.この他にも,Wangらが,がん細胞の核を活性化されたM1-likeマクロファージに移植して,マクロファージとがん細胞のハイブリッド細胞を作製し,ここから放出される,がん細胞の表面抗原とマクロファージの表面抗原を併せ持つ“aMT-exos”を利用したがん治療を報告する14)など,がんをターゲットにしたEVによる免疫制御は,がん治療の新たなストラテジーとして注目されている.
がん以外にも,COVID-19治療に使用しうるEVも報告されている.たとえば,SARS-CoV-2の受容体であるACE2を高発現させたEVは,SARS-CoV-2と宿主細胞のACE2に対して競合的に働き,SARS-CoV-2の感染を減弱させることができることが報告されている15).また,EV産生細胞を改変するアプローチではないが,肺がん細胞由来のEVの膜に,SARS-CoV-2 receptor-binding domainを,脂質を介して突き刺して提示することで,これを吸入可能なワクチンとして利用する報告などもなされている15).
このように,EVの性質をうまく利用して,これを導入した動物・患者の免疫をコントロールすることで種々の疾患治療を行う試みは近年盛んになっている.実際に,がん表面抗原・MHC分子,共刺激分子などが搭載された樹状細胞由来のEVは,抗原特異的なT細胞の活性化を引き起こすことができるがんワクチンとして臨床試験の段階まで進んでいるものも存在する16).EV産生細胞を適切に改変することで,その表面に提示する分子は自在にコントロールできると考えられることから,今後は人工的に機能を付加したEVを利用して,体内の免疫をコントロールする“synthetic immunology”的なアプローチが今後ますます盛んになっていくものと考えられる.
3. EVのバイオロジーの理解を加速するEVエンジニアリング
上述のように,EV産生細胞を改変することで,応用利用に資する機能性EVを開発することが可能になってきているが,このような改変EVは,EVの機能をより深く理解するためのツールとして利用することも可能である.典型的な例としては,CD63やCD9といった典型的なEVマーカーに,GFPなどの蛍光タンパク質や,Nanolucなどの発光タンパク質を融合したキメラタンパク質をEV産生細胞に発現し,ここから放出されるEVを,蛍光や発光によって追跡することで,その動態を理解する3, 17–19),といったことがあげられるが,本稿ではより複雑なエンジニアリングによって,EVの機能を制御する要因を理解することを試みている研究を中心に取り上げたい(EVの受領細胞のエンジニアリングを行っているものも含む).
Mathieuらは,CD63とCD9の細胞内動態を生細胞内で詳細に観察するために,これらのタンパク質とRUSH system20)の組合わせを報告している21).具体的には,streptavidin binding peptide(SBP)と蛍光タンパク質をCD63もしくはCD9の細胞外ループドメインに挿入したコンストラクトと,小胞体(ER)内への係留ドメインを付加したstreptavidinを細胞に共発現した.SBPとERにアンカリングされたstreptavidinの相互作用により,両タンパク質が発現した状態では,CD63やCD9はER内にトラップされる.この状態にbiotinを加えることで,SBPとstreptavidinの結合を競合的に解離することで,ERからそれぞれのテトラスパニンがどのような動きを示すかをパルスチェイスすることが可能になる.この動態の詳細な追跡を通じて,彼らは,EVのマーカーとして汎用されるCD63とCD9について,前者はmultivesicular body(MVB)経由で放出されるいわゆる“exosomal”なEVに載るものが多く,後者は細胞膜からくびり取られる形で放出される,いわゆる“ectosomal”なものに載るものが多いことを提唱している.
EVの体内動態を追跡したり,EVを受領した細胞にどのような変化が起きているかを解析したりするには,EVを取り込んだ細胞を永続的にラベル化できると有用であると考えられる.この点において,ZomerらはCre recombinaseを利用したEV受領細胞のラベル化法を報告している22).具体的にはEVを受領したことをモニタリングしたい細胞,もしくは動物個体の全身に,Creによる組換え前は赤色蛍光を,Creによる組換え後には緑色蛍光を発するようなレポーターを組み込んで置く.レポーター細胞を移植したマウス,もしくは全身にレポーターを発現するトランスジェニックマウスに対して,Creを発現するEV産生細胞を埋め込むことで,この細胞から放出されるEVがどの細胞に取り込まれたのかということを記録することができる.彼らは,本システムを用いて,EVを確実に受領した細胞とそうでない細胞を区別することで,低転移性の悪性度の低いがん細胞が,転移性の高いがん細胞から放出されるEVを取り込むことで,その内容物のやりとりを通じて高い転移性を獲得してしまうことを示している.本系では,Creを単に高発現しておき,EV内に受動的に取り込まれるCreを機能発揮に利用しているが,前述のような積極的なカーゴローディングシステムを利用することで,より高効率のEV取り込みレコーディングが可能になるかもしれない.
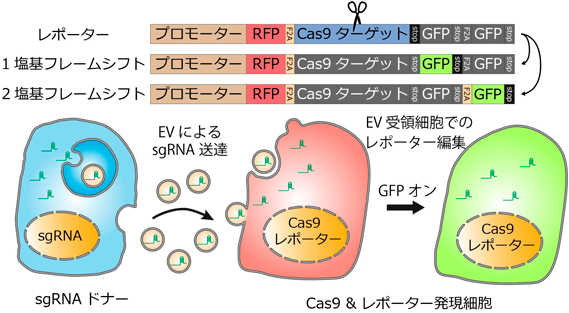
EVを取り込んだ細胞をラベル化するための別の方法として,CRISPR/Cas9システムを用いたEV取り込みのレコーディング法も開発されている23).Jongらは,mCherryとeGFPをフレームシフトを含むリンカー配列を介して連結したレポーターを開発し,これをCas9とともにEV受領細胞に発現させた.一方,EVを放出する細胞内に,レポーターのリンカー部分をターゲットにしたguide RNA(gRNA)を強制発現した.EVを介してgRNAが受領細胞へと送達された際に,レポーター内にフレームシフトが起きると,レポーター内にeGFPが発現し,EV受領細胞が永続的にラベル化されることとなる(図3).彼らは,細胞接触を介さないgRNAの送達を共培養系で確認している他,EV産生細胞や受領細胞に,siRNAを同時に導入することで,どのような遺伝子がEVの産生や取り込みに重要であるかをスクリーニング可能であることを示した.
CRISPR/Cas9システムを,EV内に封入する核酸バーコードと組み合わせることで,EVの放出をハイスループットにアッセイするシステムも報告されている24).Luらは,microRNAの一つであるmiR-30の配列をscaffoldに,15塩基のバーコード配列,EV内に取り込まれやすくなることが知られるRNA配列(EXO motif;GGAGGAG),ステムループ領域を導入した発現カセットをデザインした.ここから発現するRNAは,miRNAと同様のプロセシングを受け,バーコードとEXOmotifを有する“bEXOmiR”として成熟する.EV内に取り込まれるbEXOMiR内のバーコード量を定量することで,対応するbEXOMiRを発現する細胞から放出されたEVを推定することが可能である.CRISPR pooled screenのフォーマットにおいて,gRNAとbEXOMiRを対応させて発現することで,さまざまな因子がEVの放出に与える影響をbEXOMiRの定量を通じてスクリーニングすることが可能になり,これまで明らかとなっていなかったWntシグナルとEV放出の関連などを見いだすことに成功している.
このように,EV産生細胞やEV受領細胞をエンジニアリングしておくことで,天然のEVのみを用いているだけでは困難だったレベルで,EVの振る舞いを理解することが可能になってきている.
ここまで,本稿ではEVの発展的利用やその理解を加速するための合成生物学的アプローチについて紹介してきた.EVは,さまざまな分子を提示・内包するために発揮できる機能も多彩であり,その機能を論理的デザインによって強化・操作することで,多様な目的に利用することが可能である.また,その多彩な機能ゆえに,EVの機能を包括的に理解していくことは困難も伴うが,EVの機能を改変することで,逆に理解するというアプローチもありうるのだということを感じていただければ幸いである.
今後より精緻なEVのエンジニアリング・理解を進めるために重要な項目の一つとして,EVのヘテロ性を考慮することがあげられる.たとえば,複数の分子を改変EVに搭載した場合に,それぞれのコンポーネントが同じ小胞に載らない,といった可能性が考えられる.特定のカーゴを搭載したEVを,特定の細胞に送達したい場合に,ターゲティング用分子とカーゴ分子が同じ小胞に載らなければ,オンターゲット・オフターゲットの両面から悪影響があると考えられる.また,免疫機能を制御するEVを創出する際にも,必要な共刺激分子が同じ小胞に載らなければ,その効果が減弱してしまう,といった可能性が考えられる.複数の機能を一つのタンパク質に詰め込むことで,これらの問題を回避したり,複数のコンポーネントを利用するにしても,同じ小胞に載りやすいscaffoldタンパク質を利用するといったアプローチは重要になってくる可能性がある.EVの理解,という点に関しても,取り扱っているEVがきわめてヘテロな存在であることに留意した解釈を行うことが重要である.Small EVのマーカーとして汎用されるテトラスパニンだけに着目しても,上述のように,それぞれのマーカーが発現するEVが異なる振る舞いを示すことが認識されつつあり,EVの全貌の理解へと近づいていくには,異なるEVのポピュレーションの性質を区別して解析していく技術が今後ますます重要になっていくと考えられる.
ヘテロ性の問題以外にも,改変EVを実際の医療応用につなげていくには,品質を制御したEVをどのように安定的に生産するのか,EVの体内動態をどのように制御していくのか,といった課題が山積みである.このような課題を解決していくには,EVの機能やそれを制御する因子に関するバイオロジーの理解を徹底的に深めた上で,EVのエンジニアリング戦略を立てる,ということが重要になってくると考えられる.これを鑑みて,“EVをいじって理解し、それを踏まえてEVをさらにいじる”というサイクルを回すことができる合成生物学的なアプローチは大変魅力的であると考えられ,筆者らも,EVのヘテロ性を踏まえつつ,EVの機能を理解し,それをさらに新たなEVの発展的利用につなげるような合成生物学的研究を鋭意進めている.今後折をみて,そのような我々の研究についても紹介させていただく機会をいただければ幸甚である.