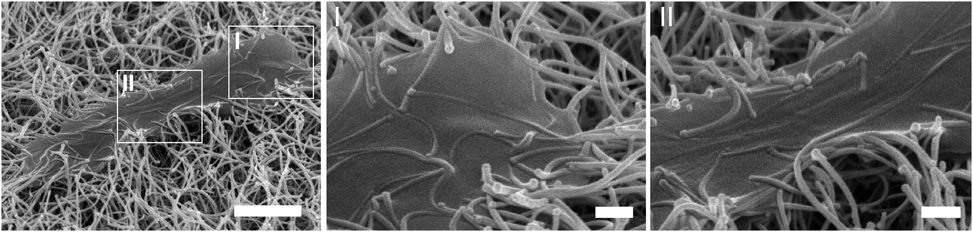
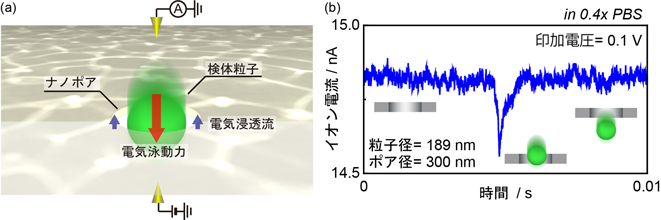
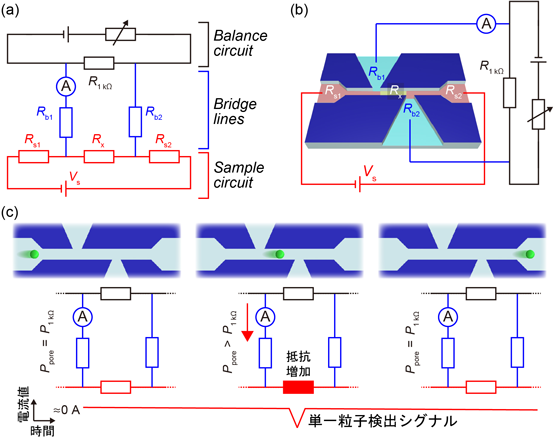
ナノワイヤ・ナノポアデバイスによる超高性能細胞外微粒子解析技術Ultra-high performance analysis of extracellular fine particles using nanowire/nanopore technology
1 名古屋大学未来社会創造機構ナノライフシステム研究所Institute of Nano-Life-Systems, Institutes of Innovation for Future Society, Nagoya University ◇ 〒464–8603 愛知県名古屋市千種区不老町 ◇ Furo-cho, Chikusa-ku, Nagoya, Aichi 464–8603, Japan
2 名古屋大学大学院工学研究科生命分子工学専攻Department of Biomolecular Engineering, Graduate School of Engineering, Nagoya University ◇ 〒464–8603 愛知県名古屋市千種区不老町 ◇ Furo-cho, Chikusa-ku, Nagoya, Aichi 464–8603, Japan
3 量子科学技術研究開発機構量子生命・医学部門量子生命科学研究所Institute of Quantum Life Science, National Institutes for Quantum Science and Technology (QST) ◇ 〒263–8555 千葉県千葉市稲毛区穴川4–9–1 ◇ 4–9–1 Anagawa Inage-ku, Chiba 263–8555, Japan
4 JSTさきがけJapan Science and Technology Agency (JST) ◇ 〒332–0012 埼玉県川口市本町4–1–8 ◇ 4–1–8 Honcho, Kawaguchi, Saitama 332–0012, Japan