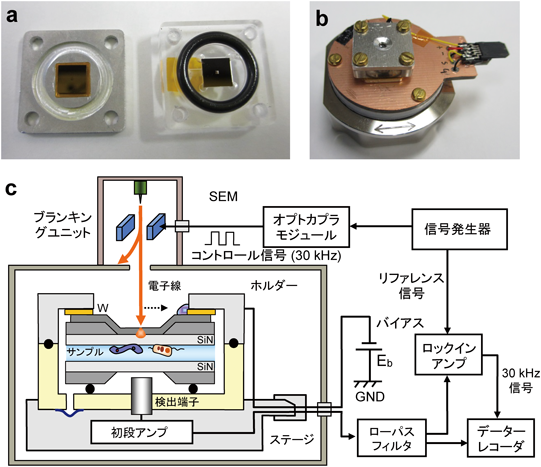
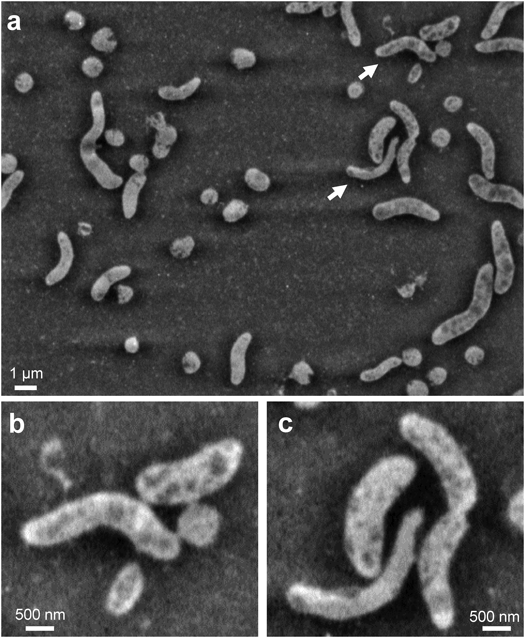
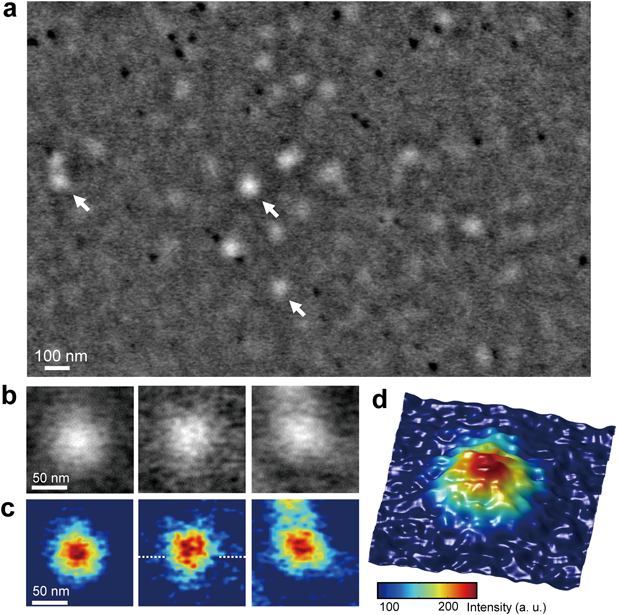
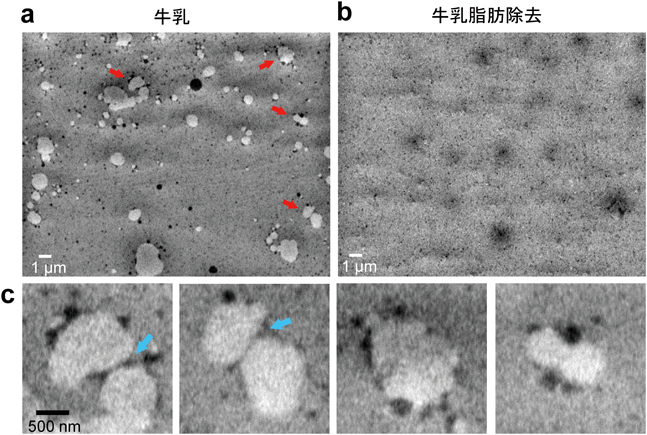
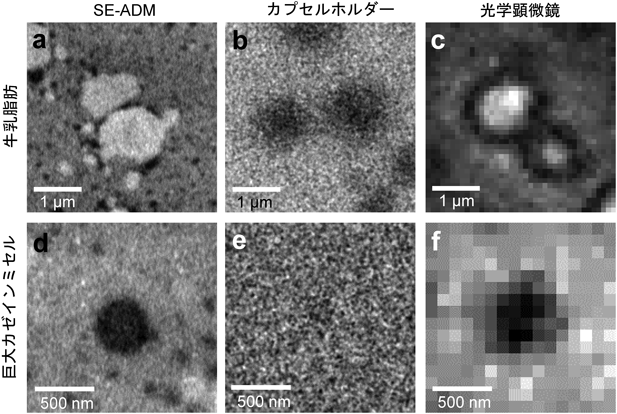
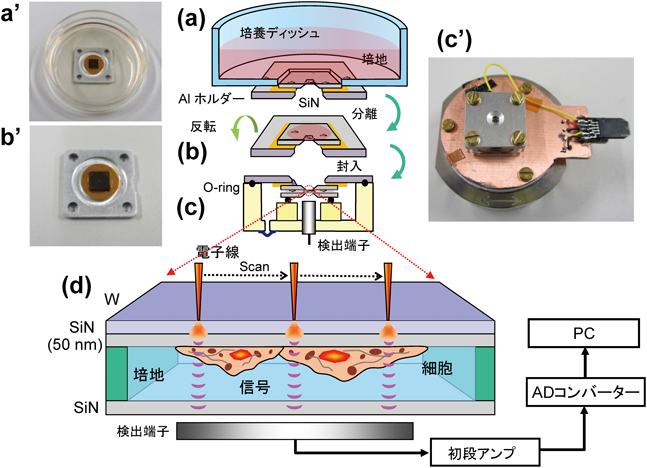
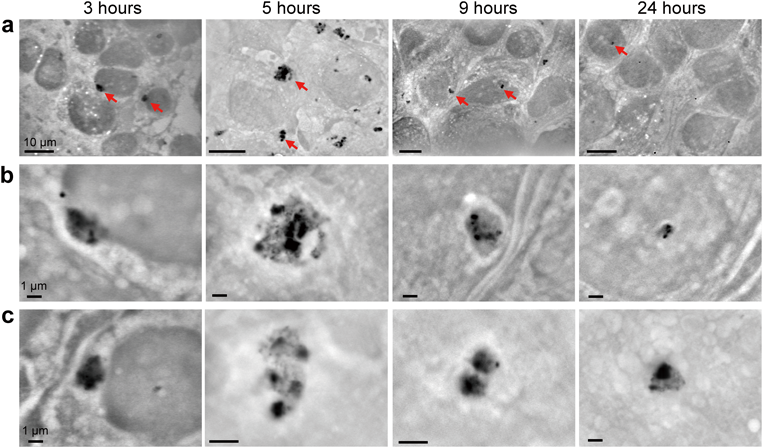
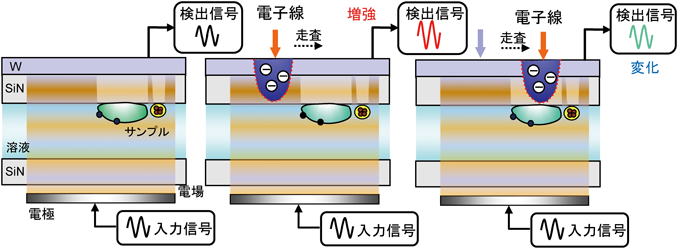
革新的液中ナノ顕微鏡開発と細胞外微粒子の包括的解明Development of innovative in-liquid nanoscopy and comprehensive elucidation of extracellular fine particles
国立研究開発機構・産業技術総合研究所健康医工学研究部門Health and Medical Research Institute, National Institute of Advanced Industrial Science and Technology (AIST) ◇ 〒305–8566 茨城県つくば市東1–1–1 ◇ Higashi 1–1–1, Tsukuba, Ibaraki 305–8566, Japan