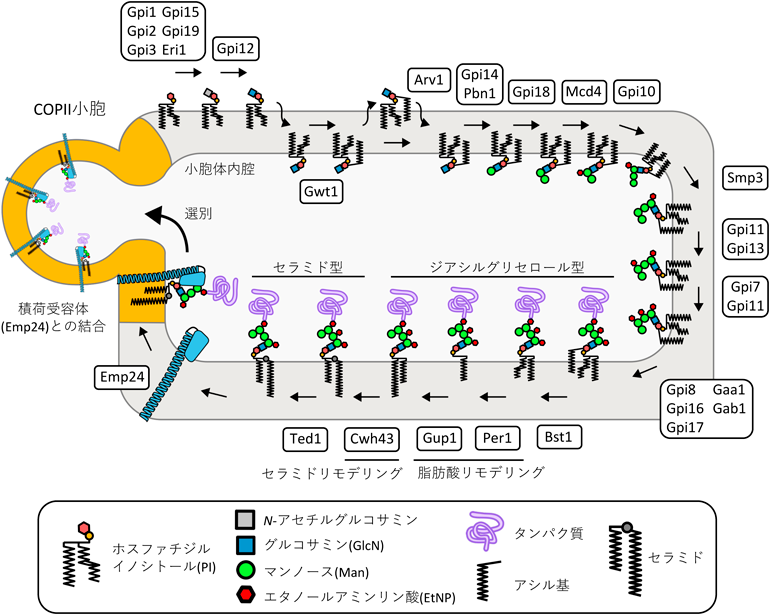
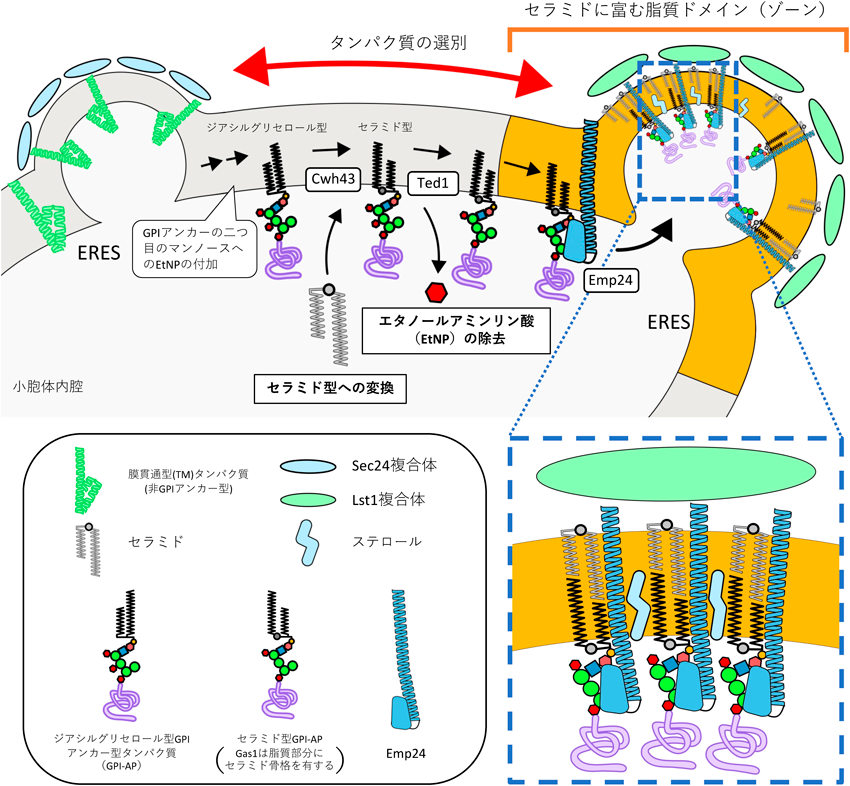
GPIアンカー型タンパク質の選別輸送の品質管理Quality-controlled GPI-anchored protein sorting
1 広島大学大学院統合生命科学研究科Graduate School of Integrated Sciences for Life, Hiroshima University ◇ 〒739–8528 広島県東広島市鏡山1–4–4 ◇ 1–4–4 Kagamiyama, Higashi-Hiroshima, Hiroshima 739–8528, Japan
2 理化学研究所光量子工学研究センターRIKEN Center for Advanced Photonics ◇ 〒351–0198 埼玉県和光市広沢2–1 ◇ 2–1 Hirosawa, Wako, Saitama 351–0198, Japan